Valsartan CAS 137862-53-4 Gehalt 98,0–102,0 % API USP-Standard
Ruifu Chemical ist der führende Anbieter von Valsartan (CAS: 137862-53-4) mit hoher Qualität und kann den USP/EP-Standard erfüllen. Ruifu Chemical liefert seit mehr als 15 Jahren APIs und pharmazeutische Zwischenprodukte.
Ruifu Chemical bietet weltweite Lieferung, wettbewerbsfähige Preise und exzellenten Service.
Kaufen Sie Valsartan und verwandte Zwischenprodukte, Bitte kontaktieren Sie uns per E-Mail: alvin@ruifuchem.com
| Chemischer Name | Valsartan |
| Synonyme | N-Valeryl-N-[2'-(1H-tetrazol-5-yl)biphenyl-4-ylmethyl]-L-valin |
| CAS-Nummer | 137862-53-4 |
| Lagerstatus | Auf Lager, Produktionsmaßstab bis zu Tonnen |
| Molekulare Formel | C24H29N5O3 |
| Molekulargewicht | 435,52 |
| Schmelzpunkt | 116,0~117,0℃ |
| Dichte | 1,212 ± 0,06 g/cm3 |
| Stabilität | Hygroskopisch |
| Löslichkeit | Löslich in Methanol |
| Echtheitszertifikat und Sicherheitsdatenblatt | Verfügbar |
| Herkunft | Shanghai, China |
| Produktkategorien | API (aktiver pharmazeutischer Inhaltsstoff) |
| Marke | Ruifu Chemical |
| Testobjekte | Spezifikationen | Ergebnisse |
| Aussehen | Weißes bis fast weißes kristallines Pulver | Weißes kristallines Pulver |
| Identifikation | ||
| IR | Muss dem Referenzstandard entsprechen | Entspricht |
| HPLC | Muss dem Referenzstandard entsprechen | Entspricht |
| Absorption (420 mm) | ≤0,02 % (λ=420 nm, C=0,05 g/ml, L=1 cm) | 0,012 % |
| Wasser (von K.F) | ≤1,00 % | 0,20 % |
| Rückstände bei der Zündung | ≤0,10 % | 0,06 % |
| Schwermetalle | ≤0,001 % | <0,001 % |
| Verwandte Substanzen | ||
| Verbindung A | ≤1,00 % | 0,37 % |
| Verbindung B | ≤0,20 % | 0,02 % |
| Verbindung C | ≤0,10 % | Nicht erkennbar |
| Jede andere individuelle Verunreinigung | ≤0,10 % | 0,02 % |
| Gesamtverunreinigungen | ≤0,30 % (ohne R-Isomer) | 0,07 % |
| Restlösungsmittel (GC) | ||
| Methanol | ≤3000 ppm | 693 Seiten pro Minute |
| Ethylacetat | ≤5000 ppm | 3013 ppm |
| N,N-Dimethylformamid | ≤880 ppm | Nicht erkennbar |
| Toluol | ≤890 ppm | 8 ppm |
| Test-/Analysemethode | 98,0–102,0 % (berechnet auf wasserfreies Material). Basis, Lösungsmittel-Freie Basis) | 99,7 % |
| Teststandard | USP 37 | Entspricht |
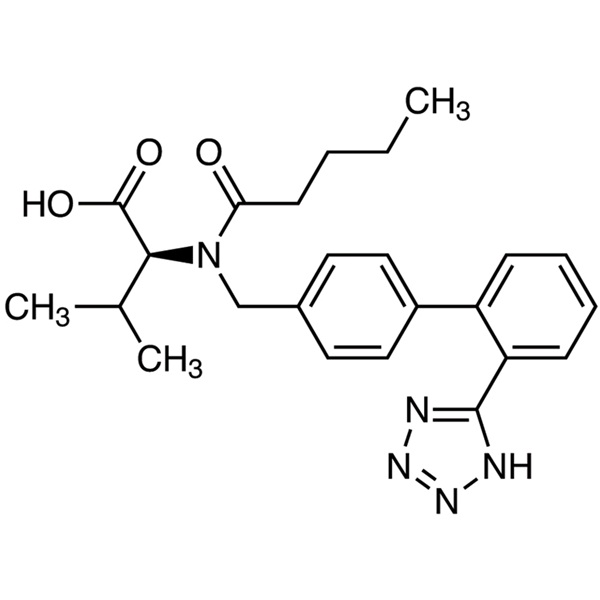
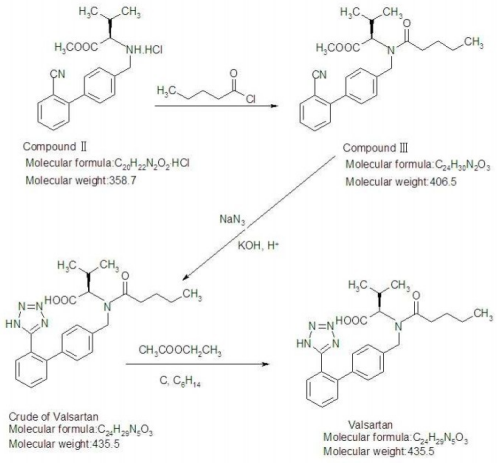
Valsartan
C24H29N5O3 435,52
l-Valin, N-(1-Oxopentyl)-N-[[2'-(1H-tetrazol-5-yl)[1,1'-biphenyl]-4-yl]methyl]-.
N-[p-(o-1H-Tetrazol-5-ylphenyl)benzyl]-N-Valeryl-l-valin [137862-53-4].
Valsartan enthält nicht weniger als 98,0 Prozent und nicht mehr als 102,0 Prozent C24H29N5O3, berechnet auf wasserfreier Basis.
Verpackung und Lagerung - In dichten Behältern aufbewahren und bei 25 °C lagern, Abweichungen zwischen 15 und 30 °C sind zulässig. Vor Feuchtigkeit und Hitze schützen.
USP-Referenzstandards<11>-
USP Valsartan RS
USP Valsartan-verwandte Verbindung A RS
(R-N-Valeryl-N-([2'-(1H-tetrazol-5-yl)biphen-4-yl]methyl)valin.
C24H29N5O3 435,52
USP Valsartan-verwandte Verbindung B RS
(S-N-Butyryl-N-([2'-(1H-tetrazol-5-yl)biphen-4-yl]methyl)-Valin.
C23H27N5O3 421,49
USP Valsartan-verwandte Verbindung C RS
(S-N-Valeryl-N-([2'-(1H-tetrazol-5-yl)biphen-4-yl]methyl)-Valinbenzylester.
C31H35N5O3 525,64
Identifikation-
A: Infrarotabsorption<197M>.
B: Die Retentionszeit des Hauptpeaks im Chromatogramm der Testzubereitung entspricht der im Chromatogramm der Standardzubereitung, wie sie im Test erhalten wurde.
Absorption - Bereiten Sie eine 1:20-Lösung in Methanol vor und bestimmen Sie die Absorption bei 420 nm. Die Absorption dividiert durch die Weglänge beträgt nicht mehr als 0,02.
Wasser, Methode I<921>: nicht mehr als 2,0 %.
Glührückstand<281>: nicht mehr als 0,1 %.
Schwermetalle, Methode II<231>: 0,001 %.
Verwandte Verbindungen-
Test 1 (Grenzwert der mit Valsartan verwandten Verbindung a)-
Mobile Phase-Bereiten Sie eine Mischung aus n-Hexan, 2-Propanol und Trifluoressigsäure (85:15:0,1) vor. Nehmen Sie bei Bedarf Anpassungen vor (siehe Systemeignung unter Chromatographie 621).
Standardlösung - Lösen Sie eine genau abgewogene Menge der USP Valsartan-verwandten Verbindung A RS in der mobilen Phase und verdünnen Sie sie quantitativ und bei Bedarf schrittweise, um eine Lösung mit einer bekannten Konzentration von etwa 0,01 mg pro ml zu erhalten.
Lösung zur Systemeignung - Genau abgewogene Mengen von USP Valsartan RS und USP Valsartan-verwandter Verbindung A RS in der mobilen Phase auflösen, um eine Lösung mit bekannten Konzentrationen von jeweils etwa 0,04 mg pro ml Valsartan und Valsartan-verwandter Verbindung A zu erhalten.
Testlösung-Übertragen Sie etwa 50 mg Valsartan, genau abgewogen, in einen 50-ml-Messkolben, geben Sie etwa 40 ml mobile Phase hinzu und behandeln Sie es 5 Minuten lang mit Ultraschall. Mit der mobilen Phase auf das Volumen verdünnen und mischen.
Chromatografisches System (siehe Chromatographie<621>)-Der Flüssigkeitschromatograph ist mit einem 230-nm-Detektor und einer 4,6 mm × 25 cm großen Säule ausgestattet, die eine 5 µm dicke Packung L40 enthält. Die Durchflussrate beträgt etwa 0,8 ml pro Minute. Chromatographieren Sie die Systemeignungslösung und zeichnen Sie die Peak-Reaktionen gemäß den Anweisungen für das Verfahren auf: Die Auflösung R zwischen der mit Valsartan verwandten Verbindung A und Valsartan beträgt nicht weniger als 2,0; und die relative Standardabweichung, bestimmt aus dem Valsartan-verwandten Verbindung-A-Peak, für Wiederholungsinjektionen beträgt nicht mehr als 5 %.
Verfahren-Injizieren Sie gleiche Volumina (ca. 10 µL) der Standardlösung und der Testlösung getrennt in den Chromatographen, zeichnen Sie die Chromatogramme auf und messen Sie die Flächen für die Hauptpeaks. Berechnen Sie den Prozentsatz der mit Valsartan verwandten Verbindung A im Valsartan-Anteil anhand der Formel:
100(CS / CU)(rU / rS)
wobei CS die Konzentration der USP Valsartan-verwandten Verbindung A RS in der Standardlösung in mg pro ml ist; CU ist die Konzentration von Valsartan in der Testlösung in mg pro ml; und rU und rS sind die Spitzenreaktionen für die mit Valsartan verwandte Verbindung A, die aus der Testlösung bzw. der Standardlösung erhalten wurden: Es wurden nicht mehr als 1,0 % gefunden.
Test 2 (Grenzwert der mit Valsartan verwandten Verbindung b, der mit Valsartan verwandten Verbindung c und anderer verwandter Verbindungen)-
Mobile Phase-Gehen Sie wie im Test beschrieben vor.
Standardlösung - Genau abgewogene Mengen von USP Valsartan RS, USP Valsartan-verwandter Verbindung B RS und USP Valsartan-verwandter Verbindung C RS in der mobilen Phase auflösen und quantitativ und bei Bedarf schrittweise mit der mobilen Phase verdünnen, um eine Lösung mit bekannten Konzentrationen von etwa 0,001 mg Valsartan pro ml, 0,001 mg Valsartan-verwandter Verbindung B pro ml und 0,001 mg zu erhalten Valsartan-verwandte Verbindung C pro ml.
Testlösung - Etwa 50 mg Valsartan, genau abgewogen, in einen 100 ml-Messkolben überführen, darin auflösen und mit der mobilen Phase auf das Volumen verdünnen und mischen.
Chromatographisches System (siehe Chromatographie<621>)-Wie im Test beschrieben vorbereiten, mit der Ausnahme, dass ein 225-nm-Detektor verwendet wird. Chromatographieren Sie die Standardlösung und zeichnen Sie die Peak-Reaktionen gemäß den Anweisungen für das Verfahren auf: Die Auflösung R zwischen der mit Valsartan verwandten Verbindung B und Valsartan beträgt nicht weniger als 1,8; die relative Standardabweichung, bestimmt aus den Peaks der Valsartan-bezogenen Verbindung B, für Wiederholungsinjektionen beträgt nicht mehr als 10,0 %; und die relative Standardabweichung, bestimmt aus den Valsartan-Peaks, für Wiederholungsinjektionen beträgt nicht mehr als 2,0 %.
Verfahren-Injizieren Sie gleiche Volumina (ca. 10 µL) der Standardlösung und der Testlösung getrennt in den Chromatographen, zeichnen Sie die Chromatogramme auf und messen Sie die Flächen für die Hauptpeaks. Berechnen Sie den Prozentsatz der mit Valsartan verwandten Verbindung B und der mit Valsartan verwandten Verbindung C im Valsartan-Anteil anhand der Formel:
100(CS / CU)(ri / rS)
wobei CS die Konzentration (in mg pro ml) der entsprechenden USP-Valsartan-verwandten Verbindung RS in der Standardlösung ist; CU ist die Konzentration von Valsartan in der Testlösung in mg pro ml; ri ist die Spitzenreaktion für die aus der Testlösung erhaltene Verunreinigung; und rS ist die Spitzenreaktion für die entsprechende Valsartan-verwandte Verbindung, die aus der Standardlösung erhalten wurde. Berechnen Sie den Prozentsatz jeder anderen Verunreinigung im Valsartan-Anteil anhand derselben Formel, wobei CS die Konzentration von USP Valsartan RS in der Standardlösung in mg pro ml ist. rS ist die Spitzenreaktion für Valsartan, erhalten aus der Standardlösung; und die anderen Begriffe sind wie oben definiert: Es werden nicht mehr als 0,2 % der mit Valsartan verwandten Verbindung B gefunden; nicht mehr als 0,1 % der mit Valsartan verwandten Verbindung C werden gefunden; nicht mehr als 0,1 % einer anderen individuellen Verunreinigung, mit Ausnahme der mit Valsartan verwandten Verbindung A, gefunden werden; und es werden nicht mehr als 0,3 % der gesamten Verunreinigungen, mit Ausnahme der mit Valsartan verwandten Verbindung A, gefunden.
Test-
Mobile Phase - Bereiten Sie eine filtrierte und entgaste Mischung aus Wasser, Acetonitril und Eisessig (500:500:1) vor. Nehmen Sie bei Bedarf Anpassungen vor (siehe Systemeignung unter Chromatographie 621).
Standardzubereitung-Eine genau abgewogene Menge USP Valsartan RS in der mobilen Phase auflösen und quantitativ und bei Bedarf schrittweise mit der mobilen Phase verdünnen, um eine Lösung mit einer bekannten Konzentration von etwa 0,5 mg pro ml zu erhalten.
Testvorbereitung - Etwa 50 mg Valsartan, genau abgewogen, in einen 100 ml-Messkolben überführen, darin auflösen und mit der mobilen Phase auf das Volumen verdünnen und mischen.
Chromatographisches System (siehe Chromatographie<621>)-Der Flüssigkeitschromatograph ist mit einem 273-nm-Detektor und einer 3,0-mm × 12,5-cm großen Säule ausgestattet, die eine 5-µm-Packung L1 enthält. Die Flussrate beträgt etwa 0,4 ml pro Minute. Chromatographieren Sie das Standardpräparat und zeichnen Sie die Peak-Reaktionen gemäß den Anweisungen für das Verfahren auf: Die relative Standardabweichung für Wiederholungsinjektionen beträgt nicht mehr als 2,0 %.
Verfahren-Injizieren Sie gleiche Volumina (ca. 10 µL) der Standardzubereitung und der Testzubereitung getrennt in den Chromatographen, zeichnen Sie die Chromatogramme auf und messen Sie die Flächen für die Hauptpeaks. Berechnen Sie die Menge (in mg) an C24H29N5O3 in der Portion Valsartan anhand der Formel:
100 °C (rU / rS)
wobei C die Konzentration von USP Valsartan RS im Standardpräparat in mg pro ml ist; und rU und rS sind die Spitzenreaktionen, die mit der Testvorbereitung bzw. der Standardvorbereitung erhalten wurden.
Paket: Flasche, Aluminiumfolienbeutel, 25 kg/Kartontrommel oder nach Kundenwunsch.
Lagerbedingungen: Halten Sie den Behälter fest verschlossen und lagern Sie ihn in einem kühlen, trockenen (2~8℃) und gut belüfteten Lager, entfernt von unverträglichen Substanzen. Vor Licht und Feuchtigkeit schützen.
Versand: Lieferung weltweit per Luftfracht, per FedEx / DHL Express. Sorgen Sie für eine schnelle und zuverlässige Lieferung.

Gefahrensymbole Xi - Reizend
Risikocodes
36/37/38 - Reizt Augen, Atemwege und Haut.
Sicherheitsbeschreibung
S26 - Bei Augenkontakt sofort mit viel Wasser ausspülen und ärztlichen Rat einholen.
S37/39 - Tragen Sie geeignete Handschuhe und Augen-/Gesichtsschutz
WGK Deutschland 3
RTECS YV9455000
HS-Code 2933990099
Shanghai Ruifu Chemical Co., Ltd. ist der führende Hersteller und Lieferant von Valsartan (CAS: 137862-53-4) mit hoher Qualität. Valsartan ist ein nichtpeptidischer Angiotensin-II-AT1-Rezeptorantagonist, blutdrucksenkend und hat das Potenzial für die Erforschung von Bluthochdruck und Herzinsuffizienz.
Die blutdrucksenkende Wirkung von Valsartan ist stärker als die von Enalapril und eignet sich zur Behandlung von Bluthochdruck, leichter bis mittelschwerer primärer Hypertonie und insbesondere sekundärer Hypertonie, die durch Nierenschäden verursacht wird. Es kann die Proteinurie bei Bluthochdruckpatienten mit Diabetes oder normaler Leberfunktion deutlich reduzieren und es kann Harnsäure und Natrium im Urin fördern, um die Niere zu schützen. Valsartan ist auch geeignet, die kardiovaskuläre Mortalität bei Hochrisikopatienten (Linksherzinsuffizienz oder -funktionsstörung) nach einem Herzinfarkt zu senken.