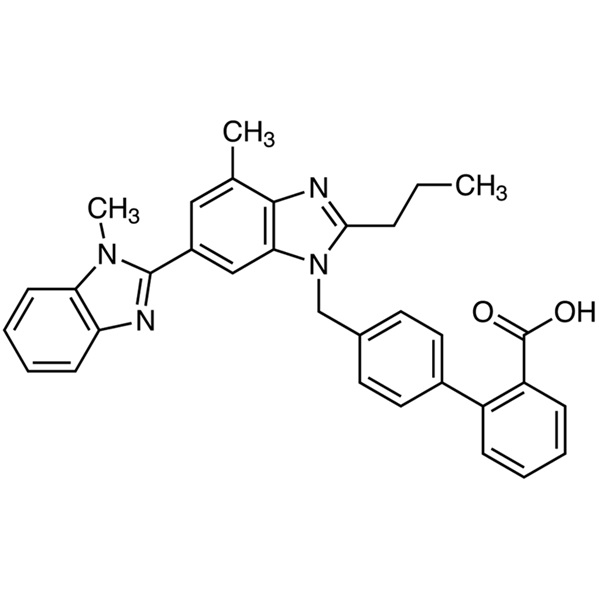
Telmisartan CAS 144701-48-4 Assay 99,0 % ~ 101,0 % API EP-Standard, hohe Qualität
Shanghai Ruifu Chemical Co., Ltd. ist der führende Anbieter von Telmisartan (CAS: 144701-48-4) mit hoher Qualität und kann den USP/EP-Standard erfüllen. DMF/CEP/GMP verfügbar.
Ruifu Chemical liefert seit mehr als 15 Jahren APIs und pharmazeutische Zwischenprodukte.
Ruifu Chemical bietet weltweite Lieferung, wettbewerbsfähige Preise und exzellenten Service.
Wenn Sie Telmisartan und verwandte Zwischenprodukte kaufen möchten, kontaktieren Sie uns bitte per E-Mail:alvin@ruifuchem.com
| Chemischer Name | Telmisartan |
| Synonyme | 4'-[[4-Methyl-6-(1-Methyl-1H-Benzimidazol-2-yl)-2-Propyl-1H-Benzimidazol-1-yl]methyl]biphenyl-2-Carboxylsäure; 4'-[(1,4'-Dimethyl-2'-Propyl[2,6'-bi-1H-Benzimidazol]-1'-yl)methyl]-[1,1'-Biphenyl]-2-Carbonsäure |
| CAS-Nummer | 144701-48-4 |
| Lagerstatus | Auf Lager, Produktionsmaßstab bis zu Tonnen |
| Molekulare Formel | C33H30N4O2 |
| Molekulargewicht | 514,63 |
| Schmelzpunkt | 261,0~263,0℃ |
| Wasserlöslichkeit | Unlöslich |
| Stabilität | Hygroskopisch |
| Lagerbedingungen | 2-8℃ |
| Echtheitszertifikat und Sicherheitsdatenblatt | Verfügbar |
| Herkunft des Produkts | Shanghai, China |
| Produktkategorien | API (aktiver pharmazeutischer Inhaltsstoff) |
| Marke | Ruifu Chemical |
| Artikel | Spezifikationen | Ergebnisse |
| Aussehen | Weißes oder leicht gelbliches kristallines Pulver | Weißes kristallines Pulver |
| Löslichkeit | Sollte die Anforderung erfüllen | Konform |
| IR-Identifizierung | Sollte der RS-Infrarotabsorption entsprechen | Konform |
| Aussehen der Lösung | Sollte die Anforderung erfüllen | Konform |
| Verwandte Substanzen | ||
| Verunreinigung A | ≤0,15 % | 0,05 % |
| Verunreinigung B | ≤0,15 % | 0,02 % |
| Verunreinigung C | ≤0,20 % | 0,03 % |
| Verunreinigung D | ≤0,20 % | 0,05 % |
| Nicht spezifizierte Verunreinigungen: | ≤0,10 % | 0,06 % |
| Gesamtverunreinigungen | ≤1,00 % | 0,30 % |
| Restlösungsmittel | ||
| Methanol | ≤0,30 % | Nicht erkannt |
| Ethanol | ≤0,50 % | 0,031 % |
| Methylendichlorid | ≤0,06 % | Nicht erkannt |
| n-Hexan | ≤0,029 % | Nicht erkannt |
| Essigsäureethylester | ≤0,50 % | Nicht erkannt |
| Toluol | ≤0,089 % | 0,025 % |
| Essigsäure | ≤0,50 % | 0,036 % |
| Verlust beim Trocknen | ≤0,50 % | 0,20 % |
| Sulfatasche | ≤0,10 % | Konform |
| Schmelzpunkt | 261,0~263,0℃ | 261,5~262,1℃ |
| Partikelgröße | 90 % weniger als 200 μm | Konform |
| Test | 99,0 % bis 101,0 % (getrocknete Substanz) | 99,9 % |
| Teststandard | Entspricht der Europäischen Pharmakopöe 7.0 | Konform |
Paket: Flasche, Aluminiumfolienbeutel, 25 kg/Kartontrommel oder nach Kundenwunsch.
Lagerbedingungen: Halten Sie den Behälter fest verschlossen. In einem kühlen, trockenen (2-8℃) und gut belüfteten Lager, entfernt von unverträglichen Substanzen, lagern. Von Sonnenlicht fernhalten; Vermeiden Sie Feuer und Wärmequellen. Feuchtigkeit vermeiden.
Versand: Lieferung in die ganze Welt per Flugzeug, auf dem Seeweg, per FedEx / DHL Express. Sorgen Sie für eine schnelle und zuverlässige Lieferung.

Gefahrensymbole Xi - Reizend
Risikocodes 36/37/38 - Reizt Augen, Atemwege und Haut.
Sicherheitsbeschreibung S22 - Staub nicht einatmen.
S24/25 - Kontakt mit Haut und Augen vermeiden.
S36 - Tragen Sie geeignete Schutzkleidung.
S26 - Bei Augenkontakt sofort mit viel Wasser ausspülen und ärztlichen Rat einholen.
WGK Deutschland 2
RTECS DV2037500
HS-Code 2933990099
Telmisartan (CAS: 144701-48-4) ist ein Benzimidazol-Derivat und ein nichtpeptidischer Angiotensin-II-Rezeptor-Antagonist mit blutdrucksenkender Wirkung. Telmisartan antagonisiert selektiv die Bindung von Angiotensin II an den AT1-Subtyp-Rezeptor, der sich in der glatten Gefäßmuskulatur und der Nebenniere befindet. Der Antagonismus führt zu einer Vasodilatation und hemmt die durch Angiotensin II vermittelte Aldosteronproduktion, was wiederum zu einer Verringerung von Natrium und Wasser sowie einer Erhöhung der Kaliumausscheidung führt, was zu einer anschließenden Senkung des Blutdrucks führt. Telmisartan ist ein neuartiges Blutdruckmedikament und wird allein oder in Kombination mit anderen Klassen von Antihypertensiva zur Behandlung von Bluthochdruck eingesetzt. Telmisartan wurde ursprünglich vom deutschen Pharmaunternehmen Boehringer Ingelheim entwickelt; Es erhielt 1991 das deutsche Patent EP502.314, wurde im November 1998 erstmals für den Markteintritt in den USA zugelassen und gelangte dann auf den deutschen, philippinischen, australischen, belgischen, britischen und anderen Markt.
C33H30N4O2
Herr 514,6
[144701-48-4]
DEFINITION
4′-[[4-Methyl-6-(1-methyl-1H-benzimidazol-2-yl)-2-propyl-1H-benzimidazol-1-yl]methyl][1,1′-biphenyl]-2-carbonsäure.
Inhalt: 99,0 Prozent bis 101,0 Prozent (getrocknete Substanz).
CHARAKTERE
Aussehen: weißes oder leicht gelbliches, kristallines Pulver.
Löslichkeit: praktisch unlöslich in Wasser, schwer löslich in Methanol, schwer löslich in Methylenchlorid. Es löst sich in einer 40 g/l-Lösung von Natriumhydroxid R auf.
Es zeigt Polymorphismus (5.9).
IDENTIFIZIERUNG
Infrarot-Absorptionsspektrophotometrie (2.2.24).
Vergleich: Telmisartan CRS.
Wenn die im Festkörper erhaltenen Spektren Unterschiede aufweisen, lösen Sie die zu untersuchende Substanz und die Referenzsubstanz getrennt in heißem wasserfreiem Ethanol R, verdampfen Sie zur Trockne und nehmen Sie mit den Rückständen neue Spektren auf.
TESTS
Aussehen der Lösung. Die Lösung ist nicht intensiver gefärbt als die Referenzlösung Y4 (2.2.2, Methode II).
Lösen Sie 0,5 g in einer 40 g/l-Lösung von Natriumhydroxid R auf und verdünnen Sie es mit demselben Lösungsmittel auf 10 ml.
Verwandte Substanzen. Flüssigkeitschromatographie (2.2.29).
Testlösung. Zu 25 mg der zu untersuchenden Substanz etwa 5 ml Methanol R und 100 μL einer 40 g/L-Lösung von Natriumhydroxid R hinzufügen. Mit Ultraschall auflösen und mit Methanol R auf 50,0 ml verdünnen.
Referenzlösung (a). Verdünnen Sie 1,0 ml der Testlösung mit Methanol R auf 10,0 ml. Verdünnen Sie 1,0 ml dieser Lösung mit Methanol R auf 100,0 ml.
Referenzlösung (b). Lösen Sie den Inhalt einer Durchstechflasche mit Telmisartan für systemische Eignung CRS (enthält die Verunreinigungen A, B, C, E und F) in 2 ml Methanol R.
Referenzlösung (c). Zu 5 mg Telmisartan zur Peakidentifizierung CRS (mit Verunreinigung D) etwa 5 ml Methanol R und 100 μl einer 40 g/l-Lösung von Natriumhydroxid R hinzufügen. Mit Ultraschall auflösen und mit Methanol R auf 10 ml verdünnen.
Spalte:
– Größe: l = 0,125 m, Ø = 4,0 mm;
– stationäre Phase: endverkapptes Octadecylsilyl-Kieselgel für die Chromatographie R (5 μm) mit einer Porengröße von 10 nm;
– Temperatur: 40 °C.
Mobile Phase:
– mobile Phase A: 2,0 g Kaliumdihydrogenphosphat R und 3,8 g Natriumpentansulfonat-Monohydrat R1 in 900 ml Wasser für die Chromatographie R auflösen, mit verdünnter Phosphorsäure R auf pH 3,0 einstellen und verdünnen
1000 mL mit Wasser für die Chromatographie R;
– mobile Phase B: Methanol R1, Acetonitril für die Chromatographie R (20:80 V/V);
Zeit (Min.) Mobile Phase A (Prozent V/V) Mobile Phase B (Prozent V/V)
0 - 3 70 30
3 - 28 70 → 20 30 → 80
Flussrate: 1 ml/min.
Nachweis: Spektrophotometer bei 230 nm.
Injektion: 10 μL.
Identifizierung von Verunreinigungen: Verwenden Sie das mit Telmisartan gelieferte Chromatogramm für die Systemeignung (CRS) und das mit der Referenzlösung (b) erhaltene Chromatogramm, um die Peaks aufgrund der Verunreinigungen A, B, C, E und F zu identifizieren.
Verwenden Sie das mit Telmisartan gelieferte Chromatogramm zur Peakidentifizierung (CRS) und das mit der Referenzlösung (c) erhaltene Chromatogramm zur Identifizierung des Peaks aufgrund der Verunreinigung D.
Relative Retention in Bezug auf Telmisartan
(Verweilzeit = ca. 15 Minuten): Verunreinigung A = ca. 0,2;
Verunreinigung E = ungefähr 0,6; Verunreinigung F = ungefähr 0,7;
Verunreinigung B = ungefähr 0,9; Verunreinigung C = ungefähr 1,5;
Verunreinigung D = ungefähr 1,6.
Systemeignung: Referenzlösung (b):
– Das mit der Referenzlösung (b) erhaltene Chromatogramm ähnelt dem mit Telmisartan gelieferten Chromatogramm für die Systemeignung CRS;
– Auflösung: mindestens 3,0 zwischen den Peaks aufgrund der Verunreinigung B und Telmisartan.
Grenzen:
– Verunreinigungen C, D: für jede Verunreinigung nicht mehr als das Doppelte der Fläche des Hauptpeaks im Chromatogramm, das mit der Referenzlösung (a) erhalten wurde (0,2 Prozent);
– Verunreinigungen A, B: für jede Verunreinigung nicht mehr als das 1,5-fache der Fläche des Hauptpeaks im Chromatogramm, das mit der Referenzlösung (a) erhalten wurde (0,15 Prozent);
– nicht spezifizierte Verunreinigungen: für jede Verunreinigung nicht mehr als die Fläche des Hauptpeaks im Chromatogramm, das mit der Referenzlösung (a) erhalten wurde (0,10 Prozent);
– insgesamt: nicht mehr als das Zehnfache der Fläche des Hauptpeaks im Chromatogramm, das mit der Referenzlösung (a) erhalten wurde (1,0 Prozent);
– Grenzwert außer Acht lassen: 0,5-fache Fläche des Hauptpeaks im Chromatogramm, das mit der Referenzlösung (a) erhalten wurde (0,05 Prozent).
Trocknungsverlust (2.2.32): maximal 0,5 Prozent, ermittelt an 1.000 g durch Trocknen im Ofen bei 105 °C.
Sulfatasche (2.4.14): maximal 0,1 Prozent, bestimmt auf 1,0 g.
TEST
0,190 g in 5 ml wasserfreier Ameisensäure R auflösen. 75 ml Essigsäureanhydrid R hinzufügen. Mit 0,1 M Perchlorsäure titrieren und den Endpunkt potentiometrisch bestimmen (2.2.20).
1 ml 0,1 M Perchlorsäure entspricht 25,73 mg C33H30N4O2.
VERUNREINIGUNGEN
Spezifizierte Verunreinigungen: A, B, C, D.
Andere nachweisbare Verunreinigungen (die folgenden Stoffe würden, wenn sie in ausreichender Menge vorhanden wären, durch einen der Tests in der Monographie nachgewiesen werden. Sie sind durch das allgemeine Akzeptanzkriterium für andere/nicht spezifizierte Verunreinigungen und/oder durch die allgemeine Monographie Stoffe für pharmazeutische Zwecke (2034) begrenzt. Es ist daher nicht notwendig, diese Verunreinigungen zum Nachweis der Konformität zu identifizieren. Siehe auch 5.10. Kontrolle von Verunreinigungen in Stoffen für pharmazeutische Zwecke): E, F, G, H, I, J.
A. 4-Methyl-6-(1-Methyl-1H-Benzimidazol-2-yl)-2-Propyl-1H-Benzimidazol,
B. 4′-[[7-Methyl-5-(1-Methyl-1H-Benzimidazol-2-yl)-2-Propyl-1H-Benzimidazol-1-yl]methyl][1,1′-Biphenyl]-2-Carbonsäure,
C. tert-Butyl 4′-[[4-methyl-6-(1-methyl-1H-benzimidazol-2-yl)-2-propyl-1H-benzimidazol-1-yl]methyl][1,1′-biphenyl]-2-carboxylat,
D. unbekannte Struktur,
E. 1-[(2′-Carboxy[1,1′-biphenyl]-4-yl)methyl]-4-methyl-2-propyl-1H-benzimidazol-6-carbonsäure,
F. 4′-[[4-methyl-6-(1-methyl-1H-benzimidazol-2-yl)-2-propyl-1H-benzimidazol-1-yl]methyl][1,1′-biphenyl]-2-carboxamid,
G. 4′-[[4-methyl-6-(1-methyl-1H-benzimidazol-2-yl)-2-propyl-1H-benzimidazol-1-yl]methyl][1,1′-biphenyl]-2-carbonitril,
H. tert-Butyl 4′-(Brommethyl)[1,1′-biphenyl]-2-carboxylat,
I. Methyl-4′-[(1,7′-Dimethyl-2′-Propyl-1H,3′H-[2,5′-bibenzimidazol]-3′-yl)methyl][1,1′-biphenyl]-2-carboxylat,
J. 4′-[(5-Chlor-1,7′-Dimethyl-2′-Propyl-1H,3′H-[2,5′-bibenzimidazol]-3′-yl)methyl][1,1′-biphenyl]-2-carbonsäure.