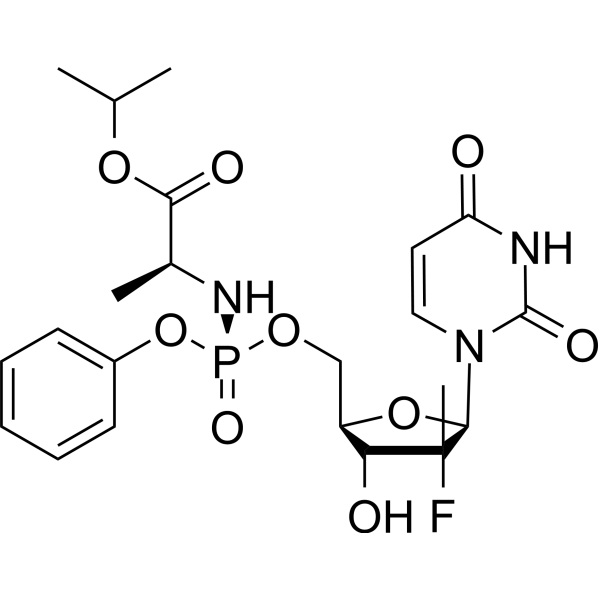
Sofosbuvir CAS 1190307-88-0 Reinheit ≥99,0 % (HPLC)
| Name | Sofosbuvir |
| Synonyme | GS-7977; PSI-7977 |
| CAS-Nummer | 1190307-88-0 |
| Lagerstatus | Auf Lager, Produktionsmaßstab bis zu Hunderten von Kilogramm |
| Molekulare Formel | C22H29FN3O9P |
| Molekulargewicht | 529,45 |
| Schmelzpunkt | 120,0~125,0℃ |
| Dichte | 1.41 |
| Löslichkeit | Löslich in DMF, DMSO und Ethanol |
| Versandbedingungen | Unter Umgebungstemperatur |
| Echtheitszertifikat und Sicherheitsdatenblatt | Verfügbar |
| Herkunft | Shanghai, China |
| Haltbarkeit | 36 Monate bei sachgemäßer Lagerung |
| Marke | Ruifu Chemical |
| Artikel | Spezifikationen |
| Aussehen | Weißes bis cremefarbenes kristallines Pulver |
| Identifikation | HPLC; RT |
| Reinheit /Analysemethode | ≥99,0 % (HPLC) |
| E.E | ≥99,0 % |
| Verlust beim Trocknen | ≤1,0 % |
| Rückstände bei der Zündung | ≤0,20 % |
| Einzelne Verunreinigung | ≤0,50 % |
| Gesamtverunreinigungen | ≤1,0 % |
| Schwermetalle | ≤20 ppm |
| Restlösungsmittel | Erfüllen Sie die Anforderungen der Spezifikationen |
| Methanol | ≤1500 ppm |
| TBME | ≤2500 ppm |
| Dichlormethan | ≤720 ppm |
| Tetrahydrofuran | ≤720 ppm |
| Toluol | ≤60 ppm |
| Teststandard | Unternehmensstandard |
| Nutzung | Sofosbuvir (CAS: 1190307-88-0) bei der Behandlung des Hepatitis-C-Virus (HCV) |
Paket: Flasche, Aluminiumfolienbeutel, 25 kg/Fass, oder nach Kundenwunsch
Lagerbedingungen:In verschlossenen Behältern kühl und trocken lagern; Vor Licht und Feuchtigkeit schützen

Sofosbuvir (CAS: 1190307-88-0) (offiziell gekennzeichnet als PSI-797, GS-7977) ist ein Phosphoramidat-Prodrug und Nukleotid-Polymerase-Inhibitor zur Behandlung chronischer Hepatitis-C-Virus (HCV)-Infektionen. Es wird empfohlen, es in Kombination mit anderen Arzneimitteln (z. B. Velpatasvir) für die Erstbehandlung der HCV-Genotypen 1, 2, 3, 4, 5 und 6 zu verwenden. Es wirkt als Nukleotidanaloga-Inhibitor und kann speziell die RNA-abhängige RNA-Polymerase NS5B (Nichtstrukturprotein 5B) von HCV hemmen.
Sofosbuvir ist das weltweit erste Medikament zur oralen Behandlung von Hepatitis C und wurde 2013 in den USA zugelassen. Eines der wichtigsten neuen zugelassenen Medikamente kann die Notwendigkeit des traditionellen Injektionsmedikaments Interferon (IFN) bei der Behandlung von chronischer Hepatitis C eines bestimmten Genotyps überflüssig machen. Es wurde erfolgreich von Gilead Science, dem weltweit größten Hersteller von Anti-HIV-Medikamenten, mit dem englischen Namen Sofosbuvir und Sovaldi entwickelt. Der weltweite Spitzenumsatz könnte 10 US-Dollar überschreiten Milliarde.