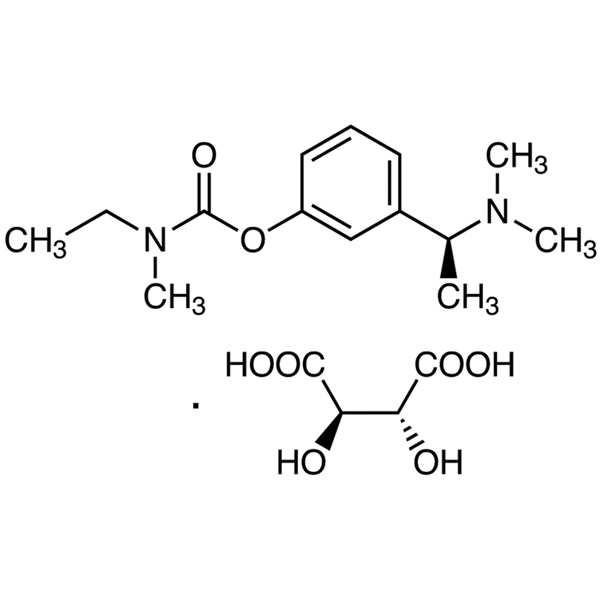
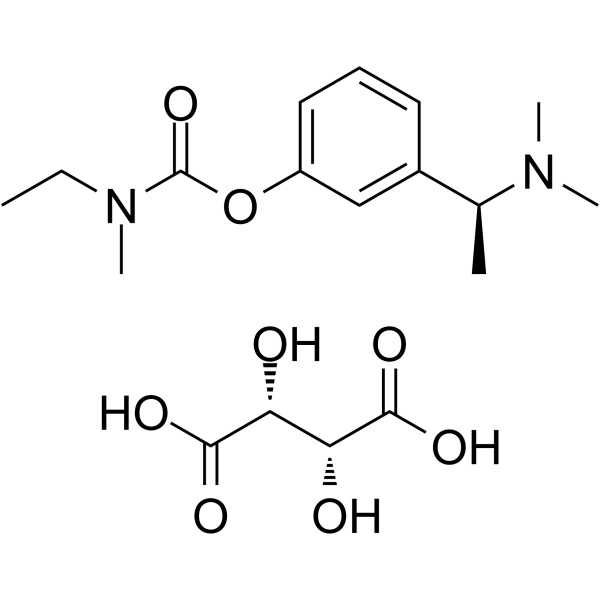
Rivastigmintartrat CAS 129101-54-8 Gehalt 98,0–102,0
Shanghai Ruifu Chemical Co., Ltd. ist der führende Hersteller von Rivastigmintartrat (CAS: 129101-54-8) mit hoher Qualität. Ruifu Chemical bietet weltweite Lieferung, wettbewerbsfähige Preise, exzellenten Service sowie die Verfügbarkeit kleiner und großer Mengen. Kaufen Sie Rivastigmintartrat, Bitte kontaktieren Sie: alvin@ruifuchem.com
| Chemischer Name | Rivastigmintartrat |
| Synonyme | Exelon; ENA-713; Rivastigmin L-Tartrat; Rivastigmin-Wasserstofftartrat; CS-118; S-Rivastigmintartrat; 3-[(S)-1-(Dimethylamino)ethyl]phenyl N-Ethyl-N-Methylcarbamat L-Tartrat; N-Ethyl-N-Methylcarbamidsäure 3-[(S)-1-(Dimethylamino)ethyl]phenylester L-Tartrat |
| Lagerstatus | Auf Lager, kommerzielle Produktion |
| CAS-Nummer | 129101-54-8 |
| Verwandtes CAS | 123441-03-2 |
| Molekulare Formel | C14H22N2O2·C4H6O6 |
| Molekulargewicht | 400,43 g/mol |
| Schmelzpunkt | 124,0 bis 128,0℃ |
| Spezifische Drehung [a]20/D | +4,0° bis +7,0° (C=5, Methanol) |
| Löslichkeit | Löslich in Methanol |
| Echtheitszertifikat und Sicherheitsdatenblatt | Verfügbar |
| Herkunft | Shanghai, China |
| Marke | Ruifu Chemical |
| Artikel | Inspektionsstandards | Ergebnisse |
| Aussehen | Weißes bis cremefarbenes, kristallines Pulver | Entspricht |
| Test | 98,0–102,0 % (auf wasserfreier Basis) | 99,8 % |
| Wasser von Karl Fischer | ≤0,50 % | 0,15 % |
| Rückstände bei der Zündung | ≤0,10 % | 0,07 % |
| Schwermetalle (Pb) | ≤20 ppm | <10 ppm |
| Phenolverunreinigung | ≤0,30 % | <0,30 % |
| DPTTA | ≤0,15 % | <0,15 % |
| Noch Unreinheit | ≤0,15 % | <0,15 % |
| Carbamat-Verunreinigung | ≤0,15 % | <0,15 % |
| Ätherverunreinigung | ≤0,15 % | <0,15 % |
| Jede andere Verunreinigung | ≤0,10 % | <0,10 % |
| Totale Verunreinigungen | ≤0,50 % | <0,50 % |
| R-Enantiomer | ≤0,30 % | <0,30 % |
| Infrarotspektrum | Im Einklang mit der Struktur | Entspricht |
| 1H-NMR-Spektrum | Im Einklang mit der Struktur | Entspricht |
| Fazit | Das Produkt wurde getestet und entspricht dem USP35-Standard | |
Paket: Fluorierte Flasche, Aluminiumfolienbeutel, 25 kg/Kartontrommel oder nach Kundenwunsch.
Lagerbedingungen: Halten Sie den Behälter fest verschlossen und lagern Sie ihn in einem kühlen, trockenen (2~8℃) und gut belüfteten Lager, entfernt von unverträglichen Substanzen. Vor Licht und Feuchtigkeit schützen.
Versand:Lieferung weltweit per Luftfracht, per FedEx / DHL Express. Sorgen Sie für eine schnelle und zuverlässige Lieferung.
Rivastigmintartrat
C14H22N2O2·C4H6O6 400,42
Ethylmethylcarbaminsäure, 3-[(S)-1-(Dimethylamino)ethyl]phenylester, (2R,3R)-2,3-Dihydroxybutandioat;
(S)-3-[1-(Dimethylamino)ethyl]phenylethylmethylcarbamat, Hydrogentartrat [129101-54-8].
Rivastigmin 250,34 [123441-03-2].
DEFINITION
Rivastigmintartrat enthält NLT 98,0 % und NMT 102,0 % der angegebenen Menge an C14H22N2O2·C4H6O6, berechnet auf wasserfreier Basis.
IDENTIFIZIERUNG
• A. Infrarotabsorption<197K>
• B. Die Retentionszeit des Hauptpeaks der Probenlösung entspricht der der Systemeignungslösung, wie sie im Test auf organische Verunreinigungen, Verfahren 2: Enantiomerenreinheit, erhalten wurde.
TEST
• Vorgehensweise
Puffer: 8,6 mg/ml monobasisches Ammoniumphosphat. Mit Ammoniaklösung einen pH-Wert von 7,0 einstellen.
Mobile Phase: Methanol, Acetonitril und Puffer (15:15:70)
Systemeignungslösung: jeweils 0,05 mg/ml USP Rivastigmin-verwandte Verbindung A RS und USP Rivastigmin-verwandte Verbindung B RS in der mobilen Phase
Standardlösung: 0,2 mg/ml USP Rivastigmintartrat RS in der mobilen Phase
Probenlösung: 0,2 mg/ml Rivastigmintartrat in der mobilen Phase
Chromatographisches System
(Siehe Chromatographie<621>, Systemeignung.)
Modus: LC
Detektor: UV 215 nm
Säule: 4,6 mm × 25 cm; 5-µm Packung L7
Flussrate: 1,2 ml/min
Injektionsgröße: 20 µL
[Hinweis-Die Flussrate kann bei Bedarf auf 1,5 ml/min angepasst werden, um eine empfohlene Retentionszeit von Rivastigmin von etwa 10 min zu erreichen. ]
Systemtauglichkeit
Beispiele: Systemeignungslösung und Standardlösung
Eignungsanforderungen
Auflösung: NLT 1,5 zwischen Rivastigmin-verwandter Verbindung A und Rivastigmin-verwandter Verbindung B, Systemeignungslösung
Säuleneffizienz: NLT 5000 theoretische Böden, Standardlösung
Tailing-Faktor: NMT 3.0, Standardlösung
Relative Standardabweichung: NMT 2,0 %, Standardlösung
Analyse
Proben: Standardlösung und Musterlösung
Berechnen Sie den Prozentsatz von C14H22N2O2·C4H6O6 in der eingenommenen Portion Rivastigmintartrat:
Ergebnis = (rU/rS) × (CS/CU) × 100
rU = Spitzenreaktion der Probenlösung
rS = Spitzenreaktion der Standardlösung
CS = Konzentration der Standardlösung (mg/ml)
CU = Konzentration der Probenlösung (mg/ml)
Akzeptanzkriterien: 98,0 % - 102,0 % auf wasserfreier Basis
VERUNREINIGUNGEN
Anorganische Verunreinigungen
• Rückstände bei der Zündung<281>: NMT 0,1 %
• Schwermetalle, Methode II<231>: NMT 20 ppm
Organische Verunreinigungen
• Verfahren 1
Lösung für mobile Phase und Systemeignung: Gehen Sie wie im Test beschrieben vor.
Standardlösung: 1,0 µg/ml USP Rivastigmintartrat RS in der mobilen Phase
Probenlösung: 1,0 mg/ml Rivastigmintartrat in der mobilen Phase
Chromatographisches System: Gehen Sie wie im Test beschrieben vor.
(Siehe Chromatographie<621>, Systemeignung.)
Systemtauglichkeit
Beispiele: Systemeignungslösung und Standardlösung
Eignungsanforderungen
Auflösung: NLT 1,5 zwischen Rivastigmin-verwandter Verbindung A und Rivastigmin-verwandter Verbindung B, Systemeignungslösung
Relative Standardabweichung: NMT 10 %, Standardlösung
Analyse [Hinweis-Die Laufzeit beträgt das Achtfache der Retentionszeit des Rivastigmin-Peaks. ]
Proben: Standardlösung und Musterlösung
Berechnen Sie den Prozentsatz jeder einzelnen Verunreinigung in der eingenommenen Rivastigmintartrat-Portion:
Ergebnis = (rU/rS) × (CS/CU) × (1/F) × 100
rU = Spitzenreaktion für jede Verunreinigung aus der Probenlösung
rS = Spitzenreaktion der Standardlösung
CS = Konzentration von USP Rivastigmintartrat RS in der Standardlösung (mg/ml)
CU = Konzentration von Rivastigmintartrat in der Probenlösung (mg/ml)
F = relativer Antwortfaktor (siehe Verunreinigungstabelle 1)
Akzeptanzkriterien
Einzelne Verunreinigungen: Siehe Verunreinigungstabelle 1.
Gesamtverunreinigungen: NMT 0,5 %
Verunreinigungstabelle 1
| Name | Relative Aufbewahrungszeit | Relativer Antwortfaktor | Akzeptanzkriterien NMT % |
| Tartrat | 0,18 | — | Missachtung |
| Phenolverunreinigunga | 0,28 | 1.6 | 0,3 |
| DPTTAb | 0,46 | 0,83 | 0,15 |
| Noch Unreinheitc | 0,57 | 1.2 | 0,15 |
| Rivastigmin | 1,0 | 1,0 | — |
| Carbamat verunreinigt | 4.1 | 1.3 | 0,15 |
| Ätherverunreinigung | 6.5 | 1.4 | 0,15 |
| Jede andere Verunreinigung | — | 1,0 | 0,1 |
ein (S)-3-[1-(Dimethylamino)ethyl]phenol.
b (+)-Di-(p-toluoyl)-d-Weinsäure (Rivastigmin-verwandte Verbindung A).
c (S)-3-[1-(Dimethylamino)ethyl]phenyldimethylcarbamat (Rivastigmin-verwandte Verbindung B).
d 3-Nitrophenylethyl(methyl)carbamat.
e (S)-N,N-Dimethyl-1-[3-(4-nitrophenoxy)phenyl]ethanamin.
• Verfahren 2: Enantiomerenreinheit
Puffer: 1,78 g dibasisches Natriumphosphat-Dihydrat und 1,38 g monobasisches Natriumphosphat in einen 1000 ml-Messkolben überführen. In Wasser auflösen und bis zum Volumen verdünnen. Mit Phosphorsäure einen pH-Wert von 6,0 einstellen.
Mobile Phase: 20 ml Acetonitril und 205 µL N,N-Dimethyloctylamin in einen 1000 ml-Messkolben überführen und mit Puffer auf das Volumen verdünnen.
Standardlösung: 0,1 µg/ml USP Rivastigmintartrat R-Isomer RS in der mobilen Phase
Empfindlichkeitslösung: 0,05 µg/ml USP Rivastigmintartrat R-Isomer RS in mobiler Phase, Standardlösung
Lösung zur Systemeignung: 100 µg/ml USP Rivastigmintartrat RS und 0,1 µg/ml USP Rivastigmintartrat R-Isomer RS in der mobilen Phase
Probenlösung: 100 µg/ml Rivastigmintartrat in der mobilen Phase
Chromatographisches System
(Siehe Chromatographie<621>, Systemeignung.)
Modus: LC
Detektor: UV 200 nm
Säule: 4,0-mm × 10-cm; Verpackung L41
Flussrate: 0,5 ml/min
Injektionsgröße: 20 µL
Systemtauglichkeit
Beispiele: Standardlösung, Sensitivitätslösung und Systemeignungslösung
Eignungsanforderungen
Auflösung: NLT 0,8 zwischen den Enantiomerenpeaks, Systemeignungslösung
[Hinweis-Die Elutionsreihenfolge ist das R-Enantiomer, gefolgt vom Rivastigmin-Peak, dem S-Enantiomer. ]
Signal-Rausch-Verhältnis: NLT 10, Empfindlichkeitslösung
Relative Standardabweichung: NMT 10 %, Standardlösung
Analyse
Proben: Standardlösung und Musterlösung
Berechnen Sie den Prozentsatz des R-Enantiomers in der eingenommenen Portion Rivastigmintartrat:
Ergebnis = (rU/rS) × (CS/CU) × 100
rU = Peak-Antwort des R-Enantiomers aus der Probenlösung
rS = Peak-Antwort des R-Enantiomers aus der Standardlösung
CS = Konzentration von R-Enantiomer in der Standardlösung (µg/ml)
CU = Konzentration von Rivastigmintartrat in der Probenlösung (µg/ml)
Akzeptanzkriterien: NMT 0,3 % des R-Enantiomers
SPEZIFISCHE TESTS
• Wasserbestimmung, Methode Ia<921>: NMT 0,5 %
ZUSÄTZLICHE ANFORDERUNGEN
• Verpackung und Lagerung: In dichten Behältern aufbewahren und bei Raumtemperatur lagern.
• USP-Referenzstandards<11>
USP Rivastigmintartrat RS
USP Rivastigmin-verwandte Verbindung A RS
Di-p-toluoyl-d-(+)-Weinsäuremonohydrat.
C20H20O9 404,37
USP Rivastigmin-verwandte Verbindung B RS
N,N-Dimethylcarbaminsäure-3-[1-(Dimethylamino)ethyl]phenylester.
C13H20N2O2 236,32
USP Rivastigmintartrat R-Isomer RS
Wie kaufe ich? Bitte kontaktieren Sie unsDr. Alvin Huang: sales@ruifuchem.com oder alvin@ruifuchem.com
15 Jahre Erfahrung?Wir verfügen über mehr als 15 Jahre Erfahrung in der Herstellung und dem Export einer breiten Palette hochwertiger pharmazeutischer Zwischenprodukte oder Feinchemikalien.
Hauptmärkte? Verkauf auf dem Inlandsmarkt, Nordamerika, Europa, Indien, Korea, Japan, Australien usw.
Vorteile? Überlegene Qualität, erschwinglicher Preis, professionelle Dienstleistungen und technischer Support, schnelle Lieferung.
Qualität Sicherheit? Strenges Qualitätskontrollsystem. Zu den professionellen Analysegeräten gehören NMR, LC-MS, GC, HPLC, ICP-MS, UV, IR, OR, K.F, ROI, LOD, MP, Klarheit, Löslichkeit, mikrobieller Grenztest usw.
Proben? Bei den meisten Produkten werden kostenlose Muster zur Qualitätsbewertung bereitgestellt. Die Versandkosten müssen vom Kunden getragen werden.
Fabrikaudit? Werksaudit willkommen. Bitte vereinbaren Sie vorab einen Termin.
Mindestbestellmenge? Kein MOQ. Eine kleine Bestellung ist akzeptabel.
Lieferzeit? Wenn der Artikel vorrätig ist, ist die Lieferung innerhalb von drei Tagen garantiert.
Transport? Per Express (FedEx, DHL), auf dem Luftweg, auf dem Seeweg.
Dokumente? Kundendienst: COA, MOA, ROS, MSDS usw. können bereitgestellt werden.
Kundenspezifische Synthese? Kann maßgeschneiderte Synthesedienste anbieten, die Ihren Forschungsanforderungen am besten entsprechen.
Zahlungsbedingungen? Die Proforma-Rechnung wird Ihnen erst nach der Auftragsbestätigung zugesandt, unter Beifügung unserer Bankdaten. Zahlung per T/T (Telex-Überweisung), PayPal, Western Union usw.
UN-IDs UN 2811 6.1 / PGII
WGK Deutschland 3
RTECS FA9550000
HS-Code 29242990
Gefahrenklasse 6.1
Verpackungsgruppe III
Rivastigmintartrat (CAS: 129101-54-8) ist das Tartrat von Rivastigmin, einem Medikament zur Behandlung der Alzheimer-Krankheit. Rivastigmin ist ein Physostigmin-Derivat, das erstmals von Novartis, Schweiz, erfolgreich entwickelt wurde. Der Handelsname ist Exelon und das Molekül hat eine Benzylcarbamat-Struktur. Es handelt sich um einen Carbamat-Gehirn-selektiven Cholinesterasehemmer, der gleichzeitig Acetylcholinesterase und Butyrylcholinesterase hemmen und die cholinerge Nervenleitung fördern kann, indem er den Abbau von Acetylcholin, das von cholinergen Neuronen freigesetzt wird, verzögert. Es kann die durch cholinerge Medikamente vermittelte kognitive Dysfunktion verbessern und dadurch die kognitive Wirkung von Patienten mit Alzheimer-Krankheit verbessern. Die Plasmaproteinbindungskapazität von Rivastigmin ist schwach, kann die Blut-Hirn-Schranke leicht passieren und weist einen hohen Grad an Gehirnselektivität auf. Es kann nicht nur selektiv auf die am stärksten gefährdeten Bereiche der Großhirnrinde und des Hippocampus einwirken, sondern auch bevorzugt die dominanten AChE-Subtypen im Gehirn hemmen, was periphere cholinerge Nebenwirkungen reduzieren und gleichzeitig heilende Wirkungen hervorrufen kann. Die Halbwertszeit von Rivastigmintartrat im Körper ist kurz und die Wirkzeit lang. Im Gegensatz zu Tacrin hat dieses Produkt eine stärkere Hemmwirkung auf das G1-Enzym im Hippocampus und Kortex. Es wird klinisch zur Behandlung von leichter bis mittelschwerer Alzheimer-Demenz eingesetzt, bei der der Verdacht auf eine Alzheimer-Krankheit oder Alzheimer-Krankheit besteht.
1. Als Acetylcholinesterase-Hemmer kann Rivastigminbicartrat die Wirkung des Muskelrelaxans Succinylcholin verbessern. Daher sollte vor der Anästhesie eine angemessene Pause eingelegt werden, um die Einnahme dieses Arzneimittels zu unterbrechen. Dieses Produkt sollte mit anderen cholinergen oder anticholinergen Präparaten kombiniert werden, wobei Vorsicht geboten ist (siehe [Wechselwirkungen mit anderen Arzneimitteln]).
2. Aufgrund ihrer pharmakologischen Wirkung können Cholinesterasehemmer Auswirkungen auf die Spannung des Vagusnervs auf die Herzfrequenz haben. Wie bei anderen cholinergen Arzneimitteln ist Vorsicht geboten, wenn es Patienten mit Sick-Sinus-Syndrom oder anderen Herzblockaden verabreicht wird (siehe „Nebenwirkungen“).
3. Die Erregung des cholinergen Nervs kann zu einer erhöhten Magensäuresekretion führen. Obwohl während des klinischen Versuchszeitraums keine Hinweise auf eine signifikante Verschlechterung der entsprechenden Symptome gefunden wurden, sollten Patienten mit einem hohen Risiko für Magengeschwüre, wie z. B. solche mit einer Magengeschwürerkrankung in der Vorgeschichte oder solche, die gleichzeitig eine Behandlung mit nichtsteroidalen entzündungshemmenden Arzneimitteln erhalten, mit Vorsicht behandelt werden.
4. Wie andere Cholinesterasehemmer sollten Patienten mit Asthma oder anderen obstruktiven Lungenerkrankungen in der Vorgeschichte mit Vorsicht angewendet werden.