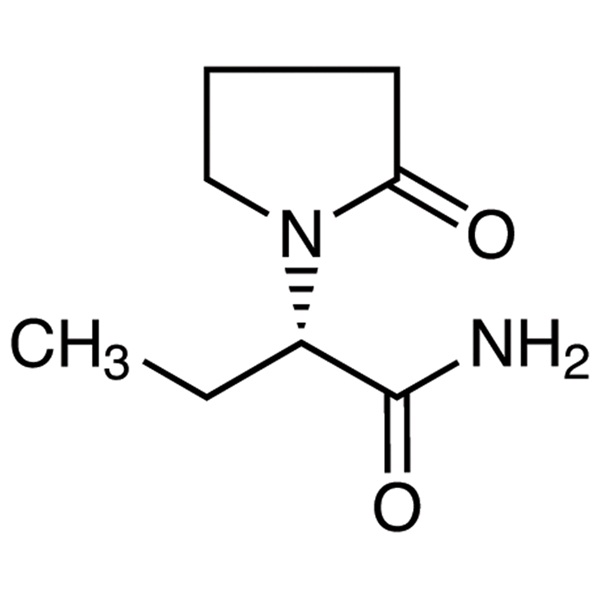
Levetiracetam LEV CAS 102767-28-2 Test 98,0 % ~ 102,0 % USP EP-Standard
Shanghai Ruifu Chemical Co., Ltd. ist der führende Hersteller von Levetiracetam (CAS: 102767-28-2) mit hoher Qualität und stabiler Qualität, API, USP/EP-Standard, Antiepileptikum der dritten Generation. Ruifu Chemical bietet weltweite Lieferung, wettbewerbsfähige Preise, exzellenten Service sowie die Verfügbarkeit kleiner und großer Mengen. Kaufen Sie Levetiracetam, Bitte kontaktieren Sie: alvin@ruifuchem.com
| Chemischer Name | Levetiracetam |
| Synonyme | LEV; (S)-2-(2-Oxo-1-pyrrolidinyl)butyramid; UCB-L059; (S)-alpha-Ethyl-2-Oxo-1-Pyrrolidinacetamid; (2S)-2-(2-Oxopyrrolidin-1-yl)butanamid |
| CAS-Nummer | 102767-28-2 |
| Lagerstatus | Auf Lager, Produktionskapazität 500 Tonnen pro Jahr |
| Molekulare Formel | C8H14N2O2 |
| Molekulargewicht | 170.21 |
| Schmelzpunkt | 116,0~119,0℃ |
| Dichte | 1,168 g/cm3 |
| Löslichkeit | Löslich in Aceton |
| Echtheitszertifikat und Sicherheitsdatenblatt | Verfügbar |
| Herkunft des Produkts | Shanghai, China |
| Produktkategorien | Antiepileptikum; API (aktiver pharmazeutischer Inhaltsstoff) |
| Marke | Ruifu Chemical |
| Artikel | Spezifikationen |
| Aussehen | Weißes oder fast weißes Kristallpulver |
| Identifikation | IR |
| Aussehen der Lösung | Klar und nicht intensiver gefärbt als BY6 |
| Grenzwert von Levetiracetam R-Enantiomer | ≤0,80 % |
| Wasser (von K.F) | ≤0,50 % |
| Rückstände bei der Zündung | ≤0,10 % |
| Schwermetalle | ≤0,001 % |
| Verwandte Substanzen | |
| Pyridin-2-ol | ≤0,025 % |
| Levetiracetamsäure | ≤0,30 % |
| Levetiracetam-verwandte Verbindung A | ≤0,05 % |
| Levetiracetam-verwandte Verbindung B | ≤0,10 % |
| Jede einzelne nicht näher bezeichnete Verunreinigung | ≤0,05 % |
| Gesamtzahl der nicht spezifizierten Verunreinigungen | ≤0,10 % |
| Gesamtverunreinigungen | ≤0,40 % |
| Restlösungsmittel | Erfüllen Sie die Spezifikation |
| Test-/Analysemethode | 98,0 % ~ 102,0 % (berechnet auf wasserfreier und lösungsmittelfreier Basis) |
| Teststandard | USP-Standard; EP-Standard |
| Bewerbung | API; Antiepileptikum der dritten Generation |
Paket: Flasche, Aluminiumfolienbeutel, 25 kg/Kartontrommel, oder nach Kundenwunsch.
Lagerbedingungen: Halten Sie den Behälter fest verschlossen und lagern Sie ihn in einem kühlen, trockenen, gut belüfteten Lager, entfernt von unverträglichen Substanzen. Von Sonnenlicht fernhalten; Vermeiden Sie Feuer und Wärmequellen. Feuchtigkeit vermeiden.
Versand: Lieferung in die ganze Welt per Flugzeug, per FedEx/DHL Express. Sorgen Sie für eine schnelle und zuverlässige Lieferung.
Levetiracetam
C8H14N2O2 170,21
1-Pyrrolidinacetamid, -ethyl-2-oxo-, (S)-;
()-(S)--Ethyl-2-oxo-1-pyrrolidinacetamid [102767-28-2].
DEFINITION
Levetiracetam enthält NLT 98,0 % und NMT 102,0 % C8H14N2O2, berechnet auf wasserfreier und lösungsmittelfreier Basis.
IDENTIFIZIERUNG
• A. Infrarotabsorption<197K>
• B. Die Retentionszeit des Hauptpeaks für Levetiracetam aus der Probenlösung entspricht der des Levetiracetam S-Enantiomers aus der Systemeignungslösung, wie im Test für den Grenzwert von Levetiracetam R-Enantiomer erhalten.
TEST
• Vorgehensweise
Puffer: 2,7 g/L monobasisches Kaliumphosphat in Wasser. Stellen Sie mit 2 %iger wässriger Kaliumhydroxidlösung (Gew./Vol.) einen pH-Wert von 5,5 ein.
Lösung A: Acetonitril und Puffer (1:19)
Lösung B: Acetonitril
Mobile Phase: Siehe die Gradiententabelle unten.
Zeit (Min.) Lösung A (%) Lösung B (%)
0 100 0
3 100 0
20 71 29
Systemgeeignete Lösung: 0,2 mg/ml USP Levetiracetam RS und 0,08 mg/ml USP Levetiracetam-verwandte Verbindung A RS in Lösung A. Zur Vorbereitung zunächst die erforderliche Menge USP Levetiracetam RS in einem geeigneten Messkolben auflösen. 10 % des Kolbenvolumens 0,1 N Kaliumhydroxid hinzufügen. Lassen Sie die Mischung etwa 15 Minuten lang bei Raumtemperatur reagieren und neutralisieren Sie sie dann durch Zugabe von 0,1 N Salzsäure in einer Menge von 10 % des Kolbenvolumens. Geben Sie die erforderliche Menge USP Levetiracetam Related Compound A RS hinzu, beschallen Sie es, um es aufzulösen, verdünnen Sie es mit Lösung A auf das Volumen und mischen Sie.
Standardlösung: 0,1 mg/ml USP Levetiracetam RS in Lösung A
Probenlösung: 0,1 mg/ml Levetiracetam in Lösung A
Chromatographisches System
(Siehe Chromatographie<621>, Systemeignung.)
Modus: LC
Detektor: UV 205 nm
Säule: 4,6 mm × 15 cm; Verpackung L1
Flussrate: 0,9 ml/min
Injektionsgröße: 10 µL
Systemtauglichkeit
Beispiel: Systemgerechte Lösung
[Hinweis-Die relativen Retentionszeiten sind in der Verunreinigungstabelle 1 angegeben.]
Eignungsanforderungen
Relative Standardabweichung: NMT 1,0 %
[Hinweis-Wenn die Systemeignungskriterien nicht erfüllt werden können, wird empfohlen, die Säulentemperatur bei 20 °C zu halten, um das System zu stabilisieren.]
Analyse
Proben: Standardlösung und Musterlösung
Berechnen Sie den Prozentsatz von C8H14N2O2 in der eingenommenen Portion Levetiracetam:
Ergebnis = [(rU/rS) × (CS/CU) × 100] F
rU = Spitzenreaktion von Levetiracetam aus der Probenlösung
rS = Spitzenreaktion von Levetiracetam aus der Standardlösung
CS = Konzentration von USP Levetiracetam RS in der Standardlösung (mg/ml)
CU = Konzentration von Levetiracetam in der Probenlösung (mg/ml)
F = Prozentsatz des Levetiracetam R-Enantiomers aus dem Test für den Grenzwert von Levetiracetam R-Enantiomer
Akzeptanzkriterien: 98,0 %-102,0 % auf wasserfreier und lösungsmittelfreier Basis
VERUNREINIGUNGEN
Anorganische Verunreinigungen
• Rückstände bei der Zündung<281>: NMT 0,1 %
• Schwermetalle, Methode II<231>: 20 ppm
Organische Verunreinigungen
• Verfahren 1: Grenzwert der mit Levetiracetam verwandten Verbindung B
[Hinweis-Führen Sie diesen Test nur durch, wenn Levetiracetam-verwandte Verbindung B eine bekannte Prozessverunreinigung ist.]
Puffer: 1,22 g Natrium-1-decansulfonat in 1 l Wasser mit etwa 1,3 ml Phosphorsäure. Stellen Sie mit 20 % (w/v) Kaliumhydroxid einen pH-Wert von 3,0 ein.
Mobile Phase: Acetonitril und Puffer (3:17)
Systemeignungslösung: 2 mg/ml USP Levetiracetam-verwandte Verbindung B RS in der mobilen Phase
Standardlösung: 0,002 mg/ml der mit USP Levetiracetam verwandten Verbindung B RS in der mobilen Phase
Probenlösung: 2,0 mg/ml Levetiracetam in der mobilen Phase
Chromatographisches System
(Siehe Chromatographie 621, Systemeignung.)
Modus: LC
Detektor: UV 200 nm
Säule: 4,6 mm × 25 cm; Verpackung L1
Flussrate: 1,0 ml/min
Injektionsgröße
Systemeignung: 10 µL
Analyse: 50 µL
Systemtauglichkeit
Beispiel: Systemgerechte Lösung
[Hinweis-Die Retentionszeit für Levetiracetam-verwandte Verbindung B beträgt 9 Minuten.]
Eignungsanforderungen
Tailing-Faktor: NMT 3,0
[Hinweis-Wenn ein deutlicher Tailing des Levetiracetam-verwandten Verbindung-B-Peaks beobachtet wird (größer als 3,0), wird empfohlen, die Säulentemperatur bei 27 °C zu halten, um das System zu stabilisieren.]
Relative Standardabweichung: NMT 2,0 %
Analyse
Proben: Standardlösung und Musterlösung
Berechnen Sie den Prozentsatz der mit Levetiracetam verwandten Verbindung B in der eingenommenen Portion Levetiracetam:
Ergebnis = (rU/rS) × (CS/CU) × (Mr1/Mr2) × 100
rU = Spitzenreaktion der mit Levetiracetam verwandten Verbindung B aus der Probenlösung
rS = Spitzenreaktion der mit Levetiracetam verwandten Verbindung B aus der Standardlösung
CS = Konzentration der mit USP Levetiracetam verwandten Verbindung B RS in der Standardlösung (mg/ml)
CU = Konzentration von Levetiracetam in der Probenlösung (mg/ml)
Mr1 = Molekulargewicht der freien Base der mit Levetiracetam verwandten Verbindung B, 102,1
Mr2 = Molekulargewicht der mit Levetiracetam verwandten Verbindung B, 138,6
Akzeptanzkriterien: NMT 0,10 %
[Hinweis-Die gemessene Menge der mit Levetiracetam verwandten Verbindung B ist in die Gesamtverunreinigungen im Test auf organische Verunreinigungen, Verfahren 2, einzubeziehen.]
• Verfahren 2
Puffer, Lösung A, Lösung B, mobile Phase, Systemeignungslösung und chromatographisches System: Gehen Sie wie im Test beschrieben vor.
Standardlösung: 0,005 mg/ml USP Levetiracetam RS in Lösung A
Probenlösung: 5 mg/ml Levetiracetam in Lösung A
Analyse
Proben: Standardlösung und Musterlösung
Berechnen Sie den Prozentsatz jeder Verunreinigung in der eingenommenen Portion Levetiracetam:
Ergebnis = (rU/rS) × (CS/CU) × (1/F) × 100
rU = Spitzenreaktion jeder Verunreinigung aus der Probenlösung
rS = Spitzenreaktion von Levetiracetam aus der Standardlösung
CS = Konzentration von USP Levetiracetam RS in der Standardlösung (mg/ml)
CU = Konzentration von Levetiracetam in der Probenlösung (mg/ml)
F = relativer Antwortfaktor (siehe Verunreinigungstabelle 1)
[Hinweis-Ignorieren Sie alle Peaks mit einer relativen Retentionszeit von 0,19 oder weniger.]
Akzeptanzkriterien
Einzelne Verunreinigungen: Siehe Verunreinigungstabelle 1.
Gesamtverunreinigungen: NMT 0,4 %
Verunreinigungstabelle 1
Name Relative Retentionszeit Relativer Reaktionsfaktor Akzeptanzkriterien, NMT (%)
Pyridin-2-ol a 0,37 1,0 0,025
Levetiracetamsäureb 0,62 1,2 0,3
Levetiracetam 1,00 - -
Levetiracetam-verwandte Verbindung Ac 1,25 0,35 0,05
Jede einzelne nicht näher bezeichnete Verunreinigung - 1,0 0,05
a Nicht im Gesamtverunreinigungsgrenzwert enthalten.
b (S)-2-(2-Oxopyrrolidin-1-yl)butansäure. Im Gesamtverunreinigungsgrenzwert enthalten.
c (S)-N-(1-Amino-1-Oxobutan-2-yl)-4-Chlorbutanamid. Wird nur dann in den Gesamtverunreinigungsgrenzwert einbezogen, wenn es sich bei der mit Levetiracetam verwandten Verbindung B um eine bekannte Prozessverunreinigung handelt.
SPEZIFISCHE TESTS
• Wasserbestimmung, Methode Ia<921>: NMT 0,5 %
• Grenzwert von Levetiracetam R-Enantiomer
Mobile Phase: n-Hexan und dehydrierter Alkohol (4:1)
Systemeignungslösung: 0,1 mg/ml USP Levetiracetam Racemic Mixture RS in der mobilen Phase
Standardlösung: 0,05 mg/ml USP Levetiracetam RS in der mobilen Phase
Probenlösung: 10 mg/ml Levetiracetam in der mobilen Phase
Chromatographisches System
(Siehe Chromatographie<621>, Systemeignung.)
Modus: LC
Detektor: UV 215 nm
Säule: 4,6 mm × 25 cm; 10µm Packung L51
Flussrate: 1,0 ml/min
Injektionsgröße: 20 µL
Systemtauglichkeit
Beispiel: Systemgerechte Lösung
[Hinweis-Die relativen Retentionszeiten für Levetiracetam R-Enantiomer und Levetiracetam S-Enantiomer betragen 0,55 bzw. 1,0.]
Eignungsanforderungen
Auflösung: NLT 4.0 zwischen dem R- und S-Enantiomere
[Hinweis-Wenn ein Auflösungsverlust (weniger als 4,0) beobachtet wird, wird empfohlen, die Säulentemperatur bei 25 °C zu halten, um das System zu stabilisieren.]
Analyse
Proben: Standardlösung und Musterlösung
Berechnen Sie den Prozentsatz des Levetiracetam-R-Enantiomers in der eingenommenen Portion Levetiracetam:
Ergebnis = (rU/rS) × (CS/CU) × 100
rU = Spitzenreaktion des Levetiracetam-R-Enantiomers aus der Probenlösung
rS = Spitzenreaktion von Levetiracetam aus der Standardlösung
CS = Konzentration von USP Levetiracetam RS in der Standardlösung (mg/ml)
CU = Konzentration von Levetiracetam in der Probenlösung (mg/ml)
Akzeptanzkriterien: NMT 0,8 %
ZUSÄTZLICHE ANFORDERUNGEN
• Verpackung und Lagerung: In gut verschlossenen Behältern aufbewahren und bei Raumtemperatur lagern.
• USP-Referenzstandards<11>
USP Levetiracetam RS
USP Levetiracetam Racemic Mixture RS
Eine 1:1-Mischung aus Levetiracetam S-Enantiomer-(2S)-2-(2-Oxopyrrolidin-1-yl)butanamid und Levetiracetam R-Enantiomer (2R)-2-(2-Oxopyrrolidin-1-yl)butanamid.
USP Levetiracetam-verwandte Verbindung A RS
(S)-N-(1-Amino-1-Oxobutan-2-yl)-4-Chlorbutanamid.
C8H14ClNO3 207,65
USP Levetiracetam-verwandte Verbindung B RS
(S)-2-Aminobutanamidhydrochlorid.
C4H10N2O·HCl 138,6

Levetiracetam (CAS: 102767-28-2), ein Derivat von Pilacetam, ist ein neuartiges Antiepileptikum der dritten Generation, das 1999 von der US-amerikanischen FDA zugelassen wurde. Es wurde ursprünglich zur Zusatzbehandlung partieller Anfälle bei Erwachsenen eingesetzt. Im Jahr 2005 wurde Levetiracetam in oralen Tabletten und Lösungen zur Zusatzbehandlung fokaler Anfälle bei Kindern ab 4 Jahren zugelassen. Es wird hauptsächlich zur additiven Behandlung fokaler Anfälle bei Erwachsenen und Kindern über 4 Jahren eingesetzt, kann aber auch nur bei fokalen Anfällen und systemischen Anfällen bei Erwachsenen angewendet werden. Es hat auch eine gewisse heilende Wirkung bei myoklonischer Epilepsie bei Teenagern, refraktärer Epilepsie, fehlender Epilepsie bei Kindern und anhaltender Epilepsie.