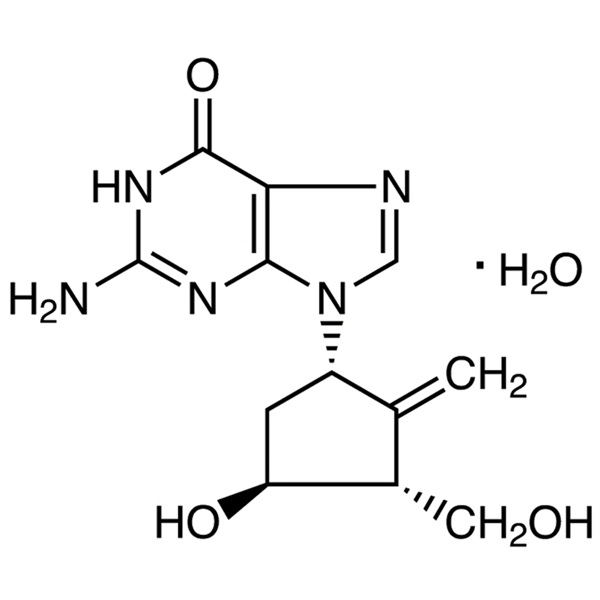
Entecavir-Monohydrat CAS 209216-23-9 Assay 98,0 % ~ 102,0 % API USP EP Standard Antivirale Hepatitis-B-Infektion
Ruifu Chemical ist der führende Anbieter von Entecavir-Monohydrat (CAS: 209216-23-9) mit hoher Qualität, das den USP/EP-Standard erfüllen kann und zur Behandlung von Hepatitis-B-Infektionen eingesetzt wird.
Ruifu liefert seit mehr als 15 Jahren APIs und pharmazeutische Zwischenprodukte.
Ruifu Chemical bietet weltweite Lieferung, wettbewerbsfähige Preise und exzellenten Service.
Kaufen Sie Entecavir-Monohydrat, Bitte kontaktieren Sie uns per E-Mail: alvin@ruifuchem.com
| Chemischer Name | Entecavir-Monohydrat |
| Synonyme | Entecavir-Hydrat; 9-[(1S,3R,4S)-4-Hydroxy-3-(hydroxymethyl)-2-methylencyclopentyl]guanin-Monohydrat |
| CAS-Nummer | 209216-23-9 |
| Lagerstatus | Auf Lager, Produktionsmaßstab bis zu Tonnen |
| Molekulare Formel | C12H17N5O4 |
| Molekulargewicht | 295,3 |
| Schmelzpunkt | >220℃ |
| Dichte | 1,81 |
| Versandbedingungen | Versand erfolgt bei Umgebungstemperatur |
| Echtheitszertifikat und Sicherheitsdatenblatt | Verfügbar |
| Herkunft des Produkts | Shanghai, China |
| Produktkategorien | API (aktiver pharmazeutischer Inhaltsstoff) |
| Marke | Ruifu Chemical |
| Artikel | Spezifikationen |
| Aussehen | Weißes oder fast weißes kristallines Pulver |
| Löslichkeit | Frei löslich in Dimethylformamid, leicht löslich in Wasser, Ethanol und Methanol |
| Identifikation IR | Das Spektrum der Probe entspricht dem des Referenzstandards |
| Identifizierung HPLC | Die Retentionszeit der Testprobe entspricht der des Referenzstandards |
| Wassergehalt (von K.F) | 5,5 % ~ 6,5 % |
| Spezifische optische Drehung | +24,0° bis +30,0° (DMF: MeOH=1:1 C=1%) (auf wasserfreier Substanz) |
| Rückstände bei der Zündung | ≤0,10 % |
| Verwandte Substanzen | |
| Furoentecavir | ≤0,10 % |
| Entecavir 1-Epimer | ≤0,10 % |
| Entecavir 3-Epimer | ≤0,10 % |
| 8-Hydroxy-Entecavir | ≤0,10 % |
| Entecavir 4-Epimer | ≤0,10 % |
| 8-Methoxy-Entecavir | ≤0,10 % |
| 4-Dimethylsilyl-Entecavir | ≤0,10 % |
| Entecavir-verwandte Verbindung A | ≤0,10 % |
| Jede nicht spezifizierte Verunreinigung | ≤0,10 % |
| Gesamtverunreinigungen | ≤0,30 % |
| Restlösungsmittel | |
| Methanol | ≤600 ppm |
| Dichlormethan | ≤300 ppm |
| Ethylacetat | ≤1000 ppm |
| Tetrahydrofuran | ≤720 ppm |
| Toluol | ≤890 ppm |
| Benzylchlorid | ≤1000 ppm |
| Benzylalkohol | ≤1000 ppm |
| Mikrobielle Grenze | |
| Gesamtzahl der Aerobic-Werte | ≤100 KBE/g |
| Hefen und Schimmelpilze | ≤10 KBE/g |
| Escherichia coli | Sollte nicht erkannt werden |
| Schwermetalle | ≤10 ppm |
| Test | 98,0 % ~ 102,0 % (HPLC; auf wasserfreier Basis) |
| Partikelgröße | 95 % der Partikel sollten innerhalb von 125 μm liegen |
| Teststandard | Unternehmensstandard; Standard der United States Pharmacopoeia (USP). |
| Nutzung | Antivirales Medikament zur Behandlung von Hepatitis-B-Infektionen |
Paket: Flasche, Aluminiumfolienbeutel, 25 kg/Kartontrommel oder nach Kundenwunsch.
Lagerbedingungen: Halten Sie den Behälter fest verschlossen. In einem kühlen, trockenen (2-15℃) und gut belüfteten Lager, entfernt von unverträglichen Substanzen, lagern. Von Sonnenlicht fernhalten; Vermeiden Sie Feuer und Wärmequellen. Feuchtigkeit vermeiden.
Versand: Lieferung in die ganze Welt per Flugzeug, auf dem Seeweg, per FedEx / DHL Express. Sorgen Sie für eine schnelle und zuverlässige Lieferung.

| Sicherheitsbeschreibung | 24/25 - Kontakt mit Haut und Augen vermeiden. |
| HS-Code | 2933990099 |
Entecavir-Monohydrat (CAS 209216-23-9) ist ein orales antivirales Medikament zur Behandlung von Hepatitis-B-Virus (HBV)-Infektionen. Entecavir Monohydrat ist ein Nukleosidanalogon (genauer gesagt ein Guaninanalogon), das die reverse Transkription, die DNA-Replikation und die Transkription im Virus hemmt. Es handelt sich um eine neue Art von Cyclopentylacylguanosin-Antihepatitis-B-Virus-Medikamenten mit ähnlichen pharmakologischen Wirkungen wie Entecavir. Es wird klinisch zur Behandlung der chronischen Hepatitis B bei Erwachsenen eingesetzt, bei der eine aktive Virusreplikation, eine erhöhte Serumtransaminase ALT oder aktive Läsionen in der Leberhistologie vorliegen. Entecavir-Monohydrat ist ein wirksamer und selektiver Inhibitor von HBV mit einem EC50 von 3,75 nM in HepG2-Zellen. Entecavir ist ein Reverse-Transkriptase-Hemmer. Es verhindert die Vermehrung des Hepatitis-B-Virus (HBV) und reduziert die Virusmenge im Körper.
Entecavir
C12H15N5O3·H2O 295,29
6H-Purin-6-on, 2-amino-1,9-dihydro-9-[(1S,3R,4S)-4-hydroxy-3-(hydroxymethyl)-2-methylencyclopentyl]-, Monohydrat;
9-[(1S,3R,4S)-4-Hydroxy-3-(hydroxymethyl)-2-methylencyclopentyl]guaninmonohydrat [209216-23-9]; UNII: 5968Y6H45M.
Wasserfrei 277,28
DEFINITION
Entecavir ist ein Monohydrat und enthält 98 % NLT und 102 % NMT von Entecavir (C12H15N5O3), berechnet auf wasserfreier Basis.
IDENTIFIZIERUNG
Ändern Sie den Text:
• A. SPEKTROSKOPISCHE IDENTIFIZIERUNGSTESTS<197>, Infrarotspektroskopie: 197A oder 197K (CN 1-Mai-2020)
• B. Die Retentionszeit des Hauptpeaks der Probenlösung entspricht der der Standardlösung, wie sie im Test ermittelt wurde.
TEST
• VERFAHREN
Lösung A: Acetonitril und Wasser (3:97)
Lösung B: Acetonitril
Mobile Phase: Siehe Tabelle 1. [HINWEIS- Die Gradientenelutionszeiten werden auf einem HPLC-System mit einem Verweilvolumen von ca. 1,0 ml ermittelt.]
Tabelle 1 Zeit (Min.) Lösung A (%) Lösung B (%)
0 100 0
8 100 0
50 77 23
75 17 83
90 100 0
100 100 0
Stammlösung zur Systemeignung: 1,0 mg/ml USP Entecavir System Suitability Mixture RS in Methanol
Systemeignungslösung: 0,2 mg/ml USP Entecavir System Suitability Mixture RS in Lösung A aus der Systemeignungsstammlösung
Standard-Stammlösung: 1,0 mg/ml USP Entecavir-Monohydrat RS in Methanol. Nach Bedarf beschallen.
Standardlösung: 0,2 mg/ml USP Entecavir Monohydrat RS in Lösung A aus der Standard-Stammlösung
Probenstammlösung: 1,0 mg/ml Entecavir in Methanol. Nach Bedarf beschallen.
Probenlösung: 0,2 mg/ml Entecavir in Lösung A aus der Probenstammlösung
Chromatographisches System
(Siehe Chromatographie<621>, Systemeignung.)
Modus: LC
Detektor: UV 254 nm
Säule: 4,6 mm × 25 cm; 5-µm Packung L1
Flussrate: 1 ml/min
Injektionsvolumen: 10 µL
Systemtauglichkeit
Beispiele: Systemeignungslösung und Standardlösung
[ HINWEIS- Die relativen Retentionszeiten der Komponenten in der Systemeignungslösung finden Sie in Tabelle 2.]
Eignungsanforderungen
Auflösung: NLT 3,5 zwischen Entecavir 1-Epimer und Entecavir; NLT 2.0 zwischen Entecavir und 8-Hydroxy-Entecavir, System
Eignungslösung
Tailing-Faktor: 0,8-1,5 für Entecavir, Systemeignungslösung
Relative Standardabweichung: NMT 1,5 %, Standardlösung
Analyse
Proben: Standardlösung und Musterlösung
Berechnen Sie den Prozentsatz von Entecavir (C12H15N5O3) in der eingenommenen Entecavir-Portion:
Ergebnis = (ru /rs) × (Cs /Cu) × 100
ru = Spitzenreaktion von Entecavir aus der Probenlösung
rs = Spitzenreaktion von Entecavir aus der Standardlösung
Cs = Konzentration von USP Entecavir Monohydrat RS in der Standardlösung (mg/ml)
Cu = Konzentration von Entecavir in der Probenlösung (mg/ml)
Akzeptanzkriterien: 98 % - 102 % auf wasserfreier Basis
VERUNREINIGUNGEN
• ORGANISCHE VERUNREINIGUNGEN
Lösung A, Lösung B, mobile Phase, Systemeignungs-Stammlösung, Systemeignungslösung, Proben-Stammlösung, Probenlösung und chromatographisches System: Gehen Sie wie im Test beschrieben vor.
Standard-Stammlösung: Verwenden Sie die Standardlösung aus dem Test.
Standardlösung: 0,2 µg/ml USP Entecavir-Monohydrat RS in Lösung A aus der Standard-Stammlösung
Systemtauglichkeit
Beispiele: Systemeignungslösung und Standardlösung
[ HINWEIS- Die relativen Retentionszeiten der Komponenten in der Systemeignungslösung finden Sie in Tabelle 2.]
Eignungsanforderungen
Auflösung: NLT 3,5 zwischen Entecavir 1-Epimer und Entecavir; NLT 2.0 zwischen Entecavir und 8-Hydroxy-Entecavir, Systemeignungslösung
Tailing-Faktor: 0,8-1,5 für Entecavir, Systemeignungslösung
Relative Standardabweichung: NMT 10,0 %, Standardlösung
Analyse
Proben: Musterlösung und Standardlösung
Berechnen Sie den Prozentsatz jeder Verunreinigung in der eingenommenen Entecavir-Portion:
Ergebnis = (ru /rs) × (Cs /Cu) × (1/F) × 100
ru = Spitzenreaktion jeder Verunreinigung aus der Probenlösung
rs = Spitzenreaktion von Entecavir aus der Standardlösung
Cs = Konzentration von USP Entecavir Monohydrat RS in der Standardlösung (mg/ml)
Cu = Konzentration von Entecavir in der Probenlösung (mg/ml)
F = relativer Responsefaktor (siehe Tabelle 2)
Akzeptanzkriterien: Siehe Tabelle 2. Spitzenwerte unter 0,05 % werden nicht berücksichtigt.
Tabelle 2
Name Relative Retentionszeit Relativer Reaktionsfaktor Akzeptanzkriterien, NMT (%)
Furoentecavir a 0,73 1,0 0,1
Entecavir 1-Epimer b 0,93 1,0 0,1
Entecavir 3-Epimer c 0,96 1,0 0,1
Entecavir 1,0 - -
8-Hydroxyentecavir d 1,03 0,67 0,1
Entecavir 4-epimer e 1,08 1,0 0,1
8-Methoxyentecavir f 1,27 0,67 0,1
4-Dimethylsilylentecavir g 1,84 1,0 0,1
Entecavir-verwandte Verbindung A 3.41 - -
Jede nicht näher bezeichnete Verunreinigung - 1,0 0,1
Gesamtverunreinigungen i - - 0,3
a 9-[(3aS,4S,6S,6aR)-3a,6-Dihydroxyhexahydro-1H-cyclopenta[c]furan-4-yl]guanin.
b 9-[(1R,3R,4S)-4-Hydroxy-3-(hydroxymethyl)-2-methylencyclopentyl]guanin.
c 9-[(1S,3S,4S)-4-Hydroxy-3-(hydroxymethyl)-2-methylencyclopentyl]guanin.
d 8-Hydroxy-9-[(1S,3R,4S)-4-hydroxy-3-(hydroxymethyl)-2-methylencyclopentyl]guanin.
e 9-[(1S,3R,4R)-4-Hydroxy-3-(hydroxymethyl)-2-methylencyclopentyl]guanin.
f 8-Methoxy-9-[(1S,3R,4S)-4-hydroxy-3-(hydroxymethyl)-2-methylencyclopentyl]guanin.
g 9-[(1S,3R,4S)-4-Hydroxydimethylsilyl-3-(hydroxymethyl)-2-methylencyclopentyl]guanin.
h Nur zur Information; quantifiziert im Test für den Grenzwert der mit Entecavir verwandten Verbindung A.
i Beinhaltet die Summe aller Verunreinigungen, die in den Tests zum Grenzwert der Entecavir-bezogenen Verbindung A und organischen Verunreinigungen gefunden wurden.
• GRENZWERT DER ENTECAVIR-VERWANDTEN VERBINDUNG A
Lösung A: 0,1 % (v/v) Trifluoressigsäure in Wasser
Lösung B: 0,1 % (v/v) Trifluoressigsäure in Acetonitril
Mobile Phase: Siehe Tabelle 3. [ HINWEIS- Die Gradientenelutionszeiten werden auf einem HPLC-System mit einem Verweilvolumen von ermittelt
ca. 1,0 ml.]
Tabelle 3
Zeit (Min.) Lösung A (%) Lösung B (%)
0 65 35
8 53 47
8,1 65 35
11 65 35
Standardlösung: 2 µg/ml USP Entecavir Related Compound A RS in Methanol
Probenlösung: 1,0 mg/ml Entecavir in Methanol. Nach Bedarf beschallen.
Chromatographisches System
(Siehe Chromatographie<621>, Systemeignung.)
Modus: LC
Detektor: UV 254 nm
Spalte: 4,6 mm × 5 cm; 5-µm Packung L1
Temperaturen
Autosampler: 4°
Säule: 30°
Flussrate: 2 ml/min
Injektionsvolumen: 10 µL
Systemtauglichkeit
Beispiel: Standardlösung
Eignungsanforderungen
Tailing-Faktor: 0,8-1,5
Relative Standardabweichung: NMT 3,0 %
Analyse
Proben: Standardlösung und Musterlösung
Berechnen Sie den Prozentsatz der mit Entecavir verwandten Verbindung A in der eingenommenen Entecavir-Portion:
Ergebnis = (ru /rs) × (Cs /Cu) × 100
ru = Spitzenreaktion der Entecavir-verwandten Verbindung A aus der Probenlösung
rs = Spitzenreaktion der Entecavir-verwandten Verbindung A aus der Standardlösung
Cs = Konzentration der USP Entecavir-verwandten Verbindung A RS in der Standardlösung (mg/ml)
Cu = Konzentration von Entecavir in der Probenlösung (mg/ml)
Akzeptanzkriterien: NMT 0,1 %
SPEZIFISCHE TESTS
• WASSERBESTIMMUNG<921>, Methode I, Methode Ic: 5,5 %-7,0 %
• OPTISCHE ROTATION<781S>, Verfahren, Spezifische Rotation
Probenlösung: 10 mg/ml Entecavir in einer Mischung aus Dimethylformamid und Methanol (50:50)
Akzeptanzkriterien: +24° bis +30°
ZUSÄTZLICHE ANFORDERUNGEN
• VERPACKUNG UND LAGERUNG: In gut verschlossenen, lichtgeschützten Behältern aufbewahren. Bei Raumtemperatur lagern.
• USP-REFERENZSTANDARDS<11>
USP Entecavir-Monohydrat RS
USP Entecavir-verwandte Verbindung A RS
3-Benzyl-4-Silylentecavir;
9-[(1S,3R,4S)-4-Dimethylphenylsilyl-3-(Benzyloxymethyl)-2-Methylencyclopentyl]guanin.
C27H31N5O2Si 485,65
USP Entecavir System Suitability Mixture RS
Die Mischung enthält Entecavir-Monohydrat und die folgenden Verunreinigungen (andere Verunreinigungen können ebenfalls vorhanden sein):
Entecavir 1-Epimer.
8-Hydroxy-Entecavir.
8-Methoxyentecavir.