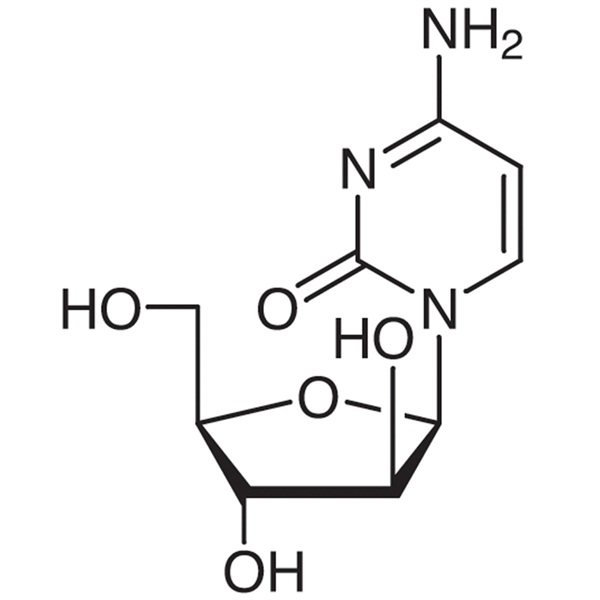
Cytarabin (Ara-C) CAS 147-94-4 Assay 98,0 % ~ 102,0 % Fabrikqualität
Shanghai Ruifu Chemical Co., Ltd. ist der führende Hersteller von Cytarabin (Ara-C) (CAS: 147-94-4) mit hoher Qualität. Ruifu Chemical bietet weltweite Lieferung, wettbewerbsfähige Preise, exzellenten Service sowie die Verfügbarkeit kleiner und großer Mengen. Kaufen Sie Cytarabin, Bitte kontaktieren Sie: alvin@ruifuchem.com
| Chemischer Name | Cytarabin |
| Synonyme | Ara-C; Arabinocytidin; Cytosin β-D-Arabinofuranosid; Arabinofuranosylcytosin; 4-Amino-1-β-D-Arabinofuranosyl-2(1H)-Pyrimidinon |
| CAS-Nummer | 147-94-4 |
| Lagerstatus | Auf Lager, kommerzielle Produktion |
| Molekulare Formel | C9H13N3O5 |
| Molekulargewicht | 243.22 |
| Schmelzpunkt | 214℃ |
| Löslichkeit in Wasser | Löslich in Wasser |
| Echtheitszertifikat und Sicherheitsdatenblatt | Verfügbar |
| Herkunft des Produkts | China |
| Marke | Ruifu Chemical |
| Artikel | Spezifikationen | Ergebnisse |
| Aussehen | Weißes kristallines Pulver | Weißes kristallines Pulver |
| Löslichkeit | Frei löslich in Wasser, sehr leicht löslich in Alkohol und in Methylenchlorid | Konform |
| Identifikation A | IR entspricht RS | Konform |
| Identifikation B | Rf Entspricht RS (HPLC) | Konform |
| Spezifische Rotation | +154,0°~+160,0° | +158,1° |
| Verlust beim Trocknen | ≤1,00 % | 0,67 % |
| Rückstände bei der Zündung | ≤0,50 % | 0,08 % |
| Schwermetalle | ≤10 ppm | <10 ppm |
| Chromatographische Verunreinigung | ||
| Gesamtverunreinigungen | ≤0,30 % (HPLC) | 0,23 % |
| Uridin | ≤0,10 % (HPLC) | <0,10 % |
| Uracil | ≤0,10 % (HPLC) | <0,10 % |
| Arabinofuranosyluracil | ≤0,30 % (HPLC) | <0,30 % |
| Test | 98,0 % ~102,0 % | 99,70 % |
| Teststandard | Entspricht USP41 | Konform |
Paket: Flasche, Aluminiumfolienbeutel, 25 kg/Kartontrommel oder nach Kundenwunsch.
Lagerbedingungen: Halten Sie den Behälter fest verschlossen und lagern Sie ihn in einem kühlen, trockenen und gut belüfteten Lager, entfernt von unverträglichen Substanzen. Von Sonnenlicht fernhalten; Vermeiden Sie Feuer und Wärmequellen. Feuchtigkeit vermeiden.
Versand: Lieferung in die ganze Welt per Flugzeug, auf dem Seeweg, per FedEx / DHL Express. Sorgen Sie für eine schnelle und zuverlässige Lieferung.
Cytarabin
C9H13N3O5 243,22
2(1H)-Pyrimidinon, 4-Amino-1--d-Arabinofuranosyl-.
1--d-Arabinofuranosylcytosin [147-94-4].
» Cytarabin enthält nicht weniger als 98,0 Prozent und nicht mehr als 102,0 Prozent C9H13N3O5, berechnet auf der Trockenbasis.
Verpackung und Lagerung- In gut verschlossenen, lichtbeständigen Behältern aufbewahren.
Beschriftung- Wenn es zur Herstellung injizierbarer Dosierungsformen verwendet werden soll, steht auf dem Etikett, dass es steril ist oder bei der Herstellung injizierbarer Dosierungsformen einer weiteren Verarbeitung unterzogen werden muss.
USP-Referenzstandards<11>-
USP Cytarabin RS
USP Endotoxin RS
USP Uracil Arabinoside RS
Identifikation-
A: Infrarotabsorption<197M>: zuvor 3 Stunden lang bei einem Druck von nicht mehr als 5 mm Quecksilbersäule bei 60 °C getrocknet.
B: Die Retentionszeit des Hauptpeaks im Chromatogramm der Testzubereitung entspricht der im Chromatogramm der Standardzubereitung, wie sie im Test erhalten wurde.
Spezifische Drehung<781S>: zwischen +154 und +160.
Testlösung: 10 mg pro ml in Wasser.
Trocknungsverlust<731>- Trocknen Sie es im Vakuum bei einem Druck von nicht mehr als 5 mm Quecksilbersäule und 60 °C 3 Stunden lang: Es verliert nicht mehr als 1,0 % seines Gewichts.
Glührückstand<281>: nicht mehr als 0,5 %.
Schwermetalle, Methode II<231>: 0,001 %.
Chromatographische Reinheit-
Phosphatpuffer- Bereiten Sie in einem geeigneten Behälter eine Lösung vor, die 0,01 M monobasisches Natriumphosphat und 0,01 M dibasisches Natriumphosphat enthält. Mit 0,1 M Natriumhydroxid oder 0,1 M Phosphorsäure einen pH-Wert von 7,0 einstellen.
Lösung A- Bereiten Sie eine gefilterte und entgaste Mischung aus Phosphatpuffer und Methanol (49:1) vor. Nehmen Sie bei Bedarf Anpassungen vor (siehe Systemeignung unter Chromatographie<621>). Bereiten Sie diese Lösung täglich frisch zu.
Lösung B- Bereiten Sie eine gefilterte und entgaste Mischung aus Phosphatpuffer und Methanol (7:3) vor. Nehmen Sie bei Bedarf Anpassungen vor (siehe Systemeignung unter Chromatographie<621>). Bereiten Sie diese Lösung täglich frisch zu.
Mobile Phase- Verwenden Sie variable Mischungen von Lösung A und Lösung B, wie unter „Chromatografisches System“ beschrieben.
Systemgerechte Lösung- Lösen Sie geeignete Mengen Uridin, USP Uracil Arabinoside RS und USP Cytarabin RS in Wasser auf, um eine Lösung mit etwa 0,02, 0,02 bzw. 5,0 mg pro ml zu erhalten.
Standardlösung- Lösen Sie eine genau abgewogene Menge USP Cytarabin RS in Wasser und verdünnen Sie es quantitativ und bei Bedarf schrittweise mit Wasser, um eine Lösung mit einer bekannten Konzentration von etwa 4 µg pro ml zu erhalten.
Testlösung- Übertragen Sie etwa 25 mg genau abgewogenes Cytarabin in einen 5,0-ml-Messkolben, lösen Sie es in Wasser auf, verdünnen Sie es mit Wasser auf das Volumen und mischen Sie es. [Hinweis-Bereiten Sie diese Lösung täglich frisch zu.]
Chromatografisches System (siehe Chromatographie<621>)-Der Flüssigkeitschromatograph ist mit einem 254-nm-Detektor und einer 4,6 mm × 25 cm großen Säule ausgestattet, die die Packung L1 enthält. Die Flussrate beträgt etwa 1 ml pro Minute. Der Chromatograph ist so programmiert, dass er variable Mischungen von Lösung A und Lösung B liefert, wobei der Prozentsatz der Lösung B zum Zeitpunkt der Injektion 0 % beträgt. Diese Zusammensetzung wird 10 Minuten lang gehalten. Lösung B wird dann über einen Zeitraum von 10 Minuten linear auf 100 % erhöht. Nachdem diese Zusammensetzung 5 Minuten lang beibehalten wurde, wird der Prozentsatz der Lösung B über einen Zeitraum von 5 Minuten linear auf 0 % verringert. Diese Zusammensetzung wird 20 Minuten lang beibehalten, um das System auszugleichen. Chromatographieren Sie die Systemeignungslösung und zeichnen Sie die Peak-Reaktionen wie im Verfahren beschrieben auf: Die relativen Retentionszeiten betragen etwa 0,55 für Uracil, 1,14 für Uridin, 1,62 für Uracilarabinosid und 1,0 für Cytarabin; und die Auflösung R zwischen Cytarabin und Uridin beträgt nicht weniger als 1,25. Chromatographieren Sie die Standardlösung und zeichnen Sie die Peak-Reaktionen wie im Verfahren beschrieben auf: Die relative Standardabweichung für Wiederholungsinjektionen beträgt nicht mehr als 3,0 %.
Vorgehensweise- Injizieren Sie gleiche Volumina (ca. 20 µL) der Standardlösung und der Testlösung in den Chromatographen, zeichnen Sie die Chromatogramme auf und messen Sie die Peak-Reaktionen. Berechnen Sie den Prozentsatz von Uracilarabinosid in der eingenommenen Portion Cytarabin anhand der Formel:
500(C/W)(ri/1,34rS)
wobei C die Konzentration von USP Cytarabin RS in der Standardlösung in mg pro ml ist; W ist das Gewicht der Probe in mg, 1,34 ist der relative Reaktionsfaktor für Uracilarabinosid; ri ist die Spitzenreaktion von Uracilarabinosid in der Testlösung; und rS ist die Spitzenreaktion von USP Cytarabin RS in der Standardlösung: Es werden nicht mehr als 0,30 % gefunden.
Berechnen Sie den Prozentsatz aller anderen Verunreinigungen im Cytarabin-Anteil anhand der Formel:
500(C / W)(ri / FrS)
wobei C die Konzentration von USP Cytarabin RS in der Standardlösung in mg pro ml ist; W ist das Gewicht der Probe in mg; ri ist die Spitzenreaktion jeder Verunreinigung in der Testlösung; rS ist die Spitzenreaktion von USP Cytarabine RS in der Standardlösung; und F, der relative Reaktionsfaktor, beträgt 2,5 für den Uracil-Peak, mit einer relativen Retentionszeit von 0,55, 1,5 für Peaks mit relativen Retentionszeiten von 0,38, 0,43 und 1,14 und 1,0 für alle anderen Peaks. Es werden nicht mehr als 0,10 % der einzelnen Verunreinigungen und nicht mehr als 0,30 % der Gesamtverunreinigungen gefunden (einschließlich Uracilarabinosid).
Sonstige Anforderungen- Wenn auf dem Etikett angegeben ist, dass Cytarabin steril ist, erfüllt es die Anforderungen für Sterilitätstests 71 und für bakterielle Endotoxine unter Cytarabin zur Injektion. Wenn auf dem Etikett angegeben ist, dass Cytarabin bei der Herstellung injizierbarer Darreichungsformen einer weiteren Verarbeitung unterzogen werden muss, erfüllt es die Anforderungen für bakterielle Endotoxine unter Cytarabin zur Injektion.
Test-
Phosphatpuffer- 0,73 g monobasisches Natriumphosphat und 1,4 g dibasisches Natriumphosphat in 1 l Wasser auflösen, mischen und filtrieren.
Mobile Phase- Bereiten Sie eine gefilterte und entgaste Mischung aus Phosphatpuffer und Methanol (95:5) vor. Nehmen Sie bei Bedarf Anpassungen vor (siehe Systemeignung unter Chromatographie<621>).
Standardvorbereitung- Lösen Sie eine genau abgewogene Menge USP Cytarabin RS in Wasser und verdünnen Sie es quantitativ und bei Bedarf schrittweise mit Wasser, um eine Lösung mit einer bekannten Konzentration von etwa 0,1 mg pro ml zu erhalten.
Auflösungslösung- Lösen Sie eine genau abgewogene Menge USP Uracil Arabinoside RS in der Standardzubereitung auf und verdünnen Sie sie quantitativ und bei Bedarf schrittweise mit der Standardzubereitung, um eine Lösung mit einer bekannten Konzentration von etwa 0,1 mg pro ml zu erhalten.
Assay-Vorbereitung- Übertragen Sie etwa 10 mg genau abgewogenes Cytarabin in einen 100-ml-Messkolben, lösen Sie es in Wasser auf, verdünnen Sie es mit Wasser und mischen Sie es.
Chromatografisches System (siehe Chromatographie<621>)-Der Flüssigkeitschromatograph ist mit einem 254-nm-Detektor und einer 4,6 mm × 25 cm großen Säule ausgestattet, die die Packung L1 enthält. Die Flussrate beträgt etwa 1,0 ml pro Minute. Chromatographieren Sie die Resolution-Lösung und zeichnen Sie die Peak-Reaktionen wie für das Verfahren angegeben auf: Die relativen Retentionszeiten betragen etwa 1,0 für Cytarabin und 1,3 für Uracil-Arabinosid; und die Auflösung R zwischen Cytarabin und Uracilarabinosid beträgt nicht weniger als 2,5. Chromatographieren Sie das Standardpräparat und zeichnen Sie die Peak-Reaktionen gemäß den Anweisungen für das Verfahren auf: Die relative Standardabweichung für Wiederholungsinjektionen beträgt nicht mehr als 2,0 %. [Hinweis-Spülen Sie die Säule nach Abschluss der Chromatographie mit einer Mischung aus Wasser und Methanol (7:3).]
Vorgehensweise- Injizieren Sie getrennt gleiche Volumina (ca. 10 µL) der Standardzubereitung und der Testzubereitung in den Chromatographen, zeichnen Sie die Chromatogramme auf und messen Sie die Reaktionen für die Hauptpeaks. Berechnen Sie die Menge (in mg) an C9H13N3O5 in der Portion Cytarabin anhand der Formel:
100 °C (rU / rS)
wobei C die Konzentration von USP Cytarabin RS in der Standardzubereitung in mg pro ml ist; und rU und rS sind die Spitzenreaktionen, die mit der Testvorbereitung bzw. der Standardvorbereitung erhalten wurden.

Risikocodes R43 - Kann bei Hautkontakt zu Sensibilisierung führen
R63 - Mögliche Gefahr einer Schädigung des ungeborenen Kindes
R36/37/38 - Reizt Augen, Atemwege und Haut.
R20/21/22 - Gesundheitsschädlich beim Einatmen, bei Berührung mit der Haut und beim Verschlucken.
Sicherheitsbeschreibung S36/37 - Tragen Sie geeignete Schutzkleidung und Handschuhe.
S37/39 - Tragen Sie geeignete Handschuhe und Augen-/Gesichtsschutz
S36 - Tragen Sie geeignete Schutzkleidung.
S26 - Bei Augenkontakt sofort mit viel Wasser ausspülen und ärztlichen Rat einholen.
WGK Deutschland 3
RTECS HA5425000
FLUKA-MARKEN-F-CODES 10-23
HS-Code 2934999099
Cytarabin (CAS: 147-94-4) ist eine Art antivirale chemische Synthese von Purinnukleosiden, die zunächst aus dem Medium von Streptomyces extrahiert und dann durch chemische Synthese hergestellt wird. Es ist ein weißes kristallines Pulver und in Wasser nur sehr schwer löslich. Sein Monophosphatester ist in Wasser leicht löslich. Es hat eine hemmende Wirkung auf verschiedene Arten von DNA-Viren wie das Herpes-simplex-Virus HSV1 und HSV2, das Hepatitis-B-Virus, das Varizella-Zoster-Virus und das Zytomegalievirus. Cytarabin (CAS: 147-94-4), ein Chemotherapeutikum, das hauptsächlich zur Behandlung von Krebserkrankungen der weißen Blutkörperchen wie akuter myeloischer Leukämie (AML) und Non-Hodgkin-Lymphom eingesetzt wird. Cytarabin ist ein Cytosin-Analogon und ein antineoplastischer Wirkstoff, der hauptsächlich in der Therapie akuter Leukämie eingesetzt wird. Cytarabin wird mit einer geringen Rate an vorübergehenden Serumenzym- und Bilirubin-Erhöhungen während der Therapie in Verbindung gebracht, wurde jedoch nur selten in Fällen einer klinisch erkennbaren akuten Leberschädigung mit Gelbsucht in Verbindung gebracht.